
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的碳原子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 1 molFe溶于过量硝酸,电子转移数为2NA
D. lmol FeI2与足量氯气反应时转移的电子数为2NA
【答案】B
【解析】
乙烯和丙烯的最简式都是CH2;过氧化钠与水反应生成氧气时,氧元素化合价由-1升高为0;Fe溶于过量硝酸生成硝酸铁;FeI2与足量氯气反应,生成氯化铁和碘单质;
乙烯和丙烯的最简式都是CH2,14 g乙烯和丙烯混合气体中的碳原子数![]() =NA,故A错误;过氧化钠与水反应生成氧气时,氧元素化合价由-1升高为0,所以生成0.1mol氧气转移的电子数为0.2NA,故B正确;Fe溶于过量硝酸生成硝酸铁,铁元素化合价由0升高为+3,所以1 molFe溶于过量硝酸,电子转移数为3NA,故C错误;FeI2与足量氯气反应,生成氯化铁和碘单质,所以lmol FeI2与足量氯气反应时转移的电子数为3NA,故D错误。
=NA,故A错误;过氧化钠与水反应生成氧气时,氧元素化合价由-1升高为0,所以生成0.1mol氧气转移的电子数为0.2NA,故B正确;Fe溶于过量硝酸生成硝酸铁,铁元素化合价由0升高为+3,所以1 molFe溶于过量硝酸,电子转移数为3NA,故C错误;FeI2与足量氯气反应,生成氯化铁和碘单质,所以lmol FeI2与足量氯气反应时转移的电子数为3NA,故D错误。


科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中, X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应至第2分钟X、Y、Z的物质的量不再变化,Y所占的体积分数为_____。
(2)该反应的化学方程式为_______________________________________________
(3)反应开始至2min,气体Z的平均反应速率为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油经裂化、裂解得到基本化学原料。以有机物Y为主要原料合成一系列产品的流程如下:

已知:R-X![]() R-CN
R-CN![]() R-COOH(R代表烃基, X代表卤素原子)
R-COOH(R代表烃基, X代表卤素原子)
请回答下列问题:
(1)Y的系统命名是________。B中的官能团名称是________。
(2)反应⑦的反应类型是________。
(3)反应①的化学方程式为__________________。
(4)写出E与足量NaOH溶液反应的化学方程式__________________。
(5)Z是B的同分异构体,Z既能发生银镜反应,又能与金属钠反应,Z的结构共有________种 (不考虑立体异构);若Z分子中只有3种不同化学环境的氢原子,写出其发生银镜反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 将过量的稀盐酸逐滴滴入稀Na2CO3溶液中,立即产生气体
B. FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路
C. Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性
D. 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为( )
A. Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3- +Ca2++OH-===CaCO3↓+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓
C. 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. MnO2 与浓盐酸反应制Cl2:MnO2+4HCl=Mn2++2Cl-+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,物质的量浓度均为0.1 mol·L-1 Na2CO3和 NaHCO3的等体积混合溶液中: 2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-)
B. △H<0,△S>0的反应都是自发反应,△H>0,△S>0的反应任何条件都是非自发反应
C. 已知:P4(g)+6Cl2(g)=4PCl3(g)△H= akJ·mol-1 P4(g)+10Cl2(g)=4PCl5(g) △H=bkJ·mol-1 P4具有正四面体结构,PCl5中P-Cl键的键能为 ckJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1,由此计算Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D. 在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)=2SO3(g) △H<0,当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设pC为溶液中粒子物质的量浓度的负对数,即:pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是
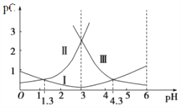
A. 曲线I表明,c(R2-)随着pH增大而逐渐增大
B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L
C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000
D. NaHR水溶液中:c(Na+)>c(HR-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol·L-1的浓硫酸来配制500mL 0.5 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是_____________________ 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序 为:②→①→③→____ →____→____→____→④(填序号) ____________
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com