
| A、0.5mol Al与足量盐酸反应,转移电子数为1NA | ||
| B、1mol氯气与足量NaOH溶液反应,转移的电子数为2NA | ||
| C、标准状况下,22.4L H2 中含质子数为2NA | ||
D、1mol CH
|
| V |
| Vm |
| 22.4L |
| 22.4L/mol |


科目:高中化学 来源: 题型:

| n(CHOH) |
| n(CO) |
| 容器 | 甲 | 乙 | 丙 |
| 投料量 | 1mol CO、2mol H2 | 1molCH3OH | 2molCH3OH |
| CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
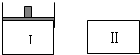 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B、若X、Y不均为气态,到达平衡后若在Ⅰ中再加入1molZ,则新平衡时Y的体积分数变大 |
| C、若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ |
| D、若X、Y不均为气态,到平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2是还原产物 |
| B、NaOH是氧化产物 |
| C、Na2O2是氧化剂,水是还原剂 |
| D、Na2O2中,-1价的氧既得电子,又失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、压强不变,充入氮气使容器体积增大 |
| B、将容器的体积缩小一半 |
| C、增加铁的量 |
| D、体积不变,充入氮气使容器压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在气体反应中,增大压强能使反应物中活化分子百分数增加 |
| B、活化分子间的碰撞一定是有效碰撞 |
| C、不同化学反应需要的活化能有可能差别很大 |
| D、反应的活化能大小不会影响化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL1mol/LFe2(SO4)3溶液和250mL3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 |
| B、因为酸性H2SO3>H2CO3,所以非金属性S>C |
| C、1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA |
| D、分别为7.8g的Na2S和Na2O2中含有的阴离子数分别为0.1NA、和0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com