
合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ· mol-1,在反应过程中,正反应速率的变化如图:
2NH3(g) ΔH=-92.4 kJ· mol-1,在反应过程中,正反应速率的变化如图:
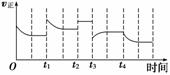
下列说法正确的是
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
电解法处理酸性含铬废水(主要含有Cr2O )时,以铁板作阴、阳极,处理过程中存在反应Cr2O
)时,以铁板作阴、阳极,处理过程中存在反应Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
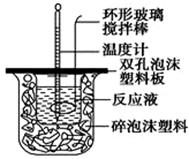
(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),
其原因是_______________________________________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
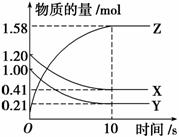
(1)从反应开始到10 s时,用Z表示的反应速率为_________________________________,
X的物质的量浓度减少了______,Y的转化率为__________________________________。
(2)该反应的化学方程式为______________________________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是________。
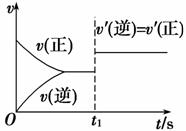
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
在开发利用金属矿物和海水资源过程中,下列说法不正确的是( )
A.工业上可用电解法冶炼得到金属铝
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水淡化的方法主要有蒸馏法、离子交换法等
D.海水中含有钾元素,需经过氧化还原反应才可得到钾单质
查看答案和解析>>
科目:高中化学 来源: 题型:
铝热反应的化学方程式为:2Al+Fe2O3 Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是________________________________________________________________________
________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________________________________________________________________________,
若观察到________________________________现象,则说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。


②将A进行如下图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH)。
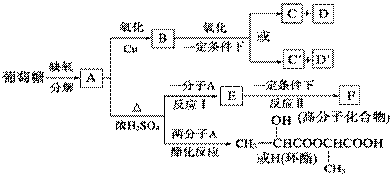
回答下列问题:
(1)C和D′属于_______(填序号,下同)。
①同系物 ②同类物质 ③同分异构体 ④同素异形体
(2) E可以发生的反应类型:_______(填序号,下同)
①消去反应 ②加成反应 ③水解反应 ④取代反应 ⑤氧化反应 ⑥缩聚反应
(3)写出D的分子式和F的结构简式:D____________,F____________,
(4)写出反应类型:(Ⅰ)__________,(Ⅱ)__________
(5)写出下列转化的化学方程式:
A生成H的反应
A与HBr反应
C′与银氨溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com