
分析 根据[Cu(NH3)4]2+的结构判断存在的化学键类型;
形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构.
解答 解:Cu2+与NH3存在配位键,NH3中N与H形成极性共价键,即存在的化学键类型为配位键和极性共价键.
[Cu(NH3)4]2+形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:①③;平面正方形.
点评 本题考查配合物的成键情况,难度中等,难度不大,注重对基础知识的考查.


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数为12 | B. | 核电荷数为12 | ||
| C. | 电子数为28 | D. | 中子数与质子数之差为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
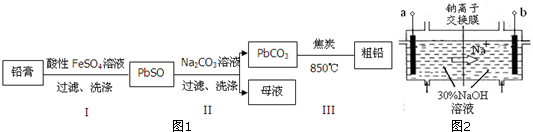
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以B表示的平均反应速率为v(B)=0.0625mol•L-1•s-1 | |
| B. | 4min时,A的物质的量为0.75mol | |
| C. | 该反应方程式中,x=2 | |
| D. | 4min时,B的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业盐可代替食盐食用 | B. | 加碘食盐添加的是碘酸钾 | ||
| C. | 食盐是侯氏制碱的主要原料之一 | D. | 工业上电解饱和食盐水可制取烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
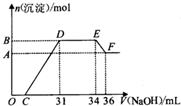 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=Al(OH)4- | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 向裂化汽油和苯乙烯中分别加入溴水,溴水均褪色 | |
| C. | 分别加热盛有氯化铵和单质碘的试管,内壁或管口均有固体凝结 | |
| D. | 分别向鸡蛋白溶液中加入饱和硫酸铵溶液和甲醛溶液,均有固体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com