(2012?江苏一模)氢、氮、氧三种元素可以分别两两组成如氮氧化物、氮氢化物和氢氧化物等,科学家们已经研究和利用其特殊性质开发其特有的功能.
(1)肼(N
2H
4)的制备方法之一是将NaClO溶液和NH
3反应制得,试写出该反应的化学方程式
NaClO+2NH3=N2H4+NaCl+H2O
NaClO+2NH3=N2H4+NaCl+H2O
.
(2)肼可作为火箭发动机的燃料,NO
2为氧化剂,反应生成N
2和水蒸气.
N
2+2O
2(g)=2NO
2(g);△H=+67.7kJ?mol
-1N
2H
4+O
2(g)=N
2(g)+2H
2O(g);△H=-534kJ?mol
-1写出肼和NO
2反应的热化学方程式:
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ?mol-1
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ?mol-1
.
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.该电池放电时,负极的电极反应式为
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
.
(4)过氧化氢的制备方法很多,下列方法中原子利用率最高的是
D
D
(填序号).
A.BaO
2+H
2SO
4═BaSO
4↓+H
2O
2B.2NH
4HSO
4(NH
4)
2S
2O
8+H
2↑;(NH
4)
2S
2O
8+2H
2O═2NH
4HSO
4+H
2O
2C.CH
3CHOHCH
3+O
2→CH
3COCH
3+H
2O
2D.乙基蒽醌法见图1
(5)根据本题(4)中B选项的方法,若要制得1mol H
2O
2,电解时转移电子数为
2NA
2NA
.
(6)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图2、图3所示.
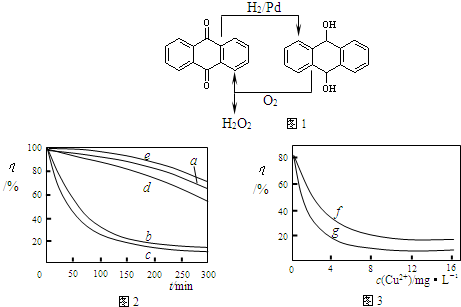
注:以上实验均在温度为20℃、w(H
2O
2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L
-1的条件下进行.图2中曲线a:H
2O
2;b:H
2O
2+Cu
2+;c:H
2O
2+Fe
2+;d:H
2O
2+Zn
2+;e:H
2O
2+Mn
2+;图3中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
B
B
(填序号).
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.



 步步高达标卷系列答案
步步高达标卷系列答案
