
【题目】二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______
(2)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为______
②该温度下的反应的平衡常数为______
(3)一定条件下的密闭容器中,在总反应达到平衡前,要使在单位时间内提高CO的转化率,可以采取的措施是______
A 增大压强 B 加入催化剂C 减少CO2的浓度 D 降低体系温度
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图1,试解释原因:______
(5)该研究者还测定了相同条件下氢气的残留量,请在图2中划出H2的残留量随温度变化的曲线______

【答案】3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)△H=-247KJ/mol 0.10mol/(Lmin) 625 AB 在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小 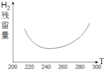
【解析】
(1)①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
盖斯定律计算①×2+(②+③)得到CO和H2为原料生产CH3OCH3的热化学方程式为:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)△H=-247kJ/mol;
(2)①2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1,反应在2min内以CH3OCH3表示的化学反应速率v(CH3OCH3)=![]() v(CH3OH)=
v(CH3OH)=![]() ×
×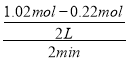 =0.10mol/(Lmin),
=0.10mol/(Lmin),
故答案为:0.10mol/(Lmin);
②2CH3OH(g)CH3OCH3(g)+H2O(g)
起始量(mol/L) 0.51 0 0
变化量(mol/L) 0.5 0.25 0.25
平衡量(mol/L) 0.01 0.25 0.25
该温度下的反应的平衡常数K=![]() =625;
=625;
(3)3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)△H=-247KJ/mol,反应为气体体积减小的放热反应,要使在单位时间内提高CO的转化率,应将平衡正向移动或加快化学反应速率。
A.增大压强 既能加快化学反应速率,又能使平衡正向移动,CO转化率增大,选项A正确;
B.加入催化剂加快反应速率,缩短达到平衡的时间,单位时间内提高CO的转化率,选项B正确;
C.减少CO2的浓度,反应速率减小,单位时间内CO转化率减小,选项C错误;
D.降低体系温度,反应速率减小,单位时间内提高CO的转化率减小,选项D错误;
答案选AB;
(4)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;
(5)3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)△H=-247KJ/mol,反应为放热反应,反应开始正向进行,氢气残留量减小,到240°C左右反应达到平衡状态,升温平衡逆向移动,氢气残留量增加,H2的残留量随温度变化的曲线为: ;
;


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2 → O2。
(1)该反应中的还原剂是_____。
(2)该反应中,发生还原反应的过程是_____→______。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目______。
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下体积为______________L。
(5)已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O,MnO4-→Mn2+,IO3-→I2,HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是_____。
A.H2O2 B.MnO4- C.IO3- D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.CaCl2(aq) ![]() CaCO3
CaCO3 ![]() CaO
CaO
B.Na ![]() Na2O
Na2O ![]() NaOH
NaOH
C.(C6H10O5)n(淀粉) ![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖) ![]() C2H5OH
C2H5OH
D.Cu2S ![]() Cu
Cu ![]() CuSO4
CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率速率受多种因素影响,实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是( )
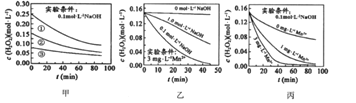
A. 图甲表明,其他条件相同时,![]() 浓度越大,其分解速率越快
浓度越大,其分解速率越快
B. 图甲![]() 和图乙因起始浓度不同不能比较
和图乙因起始浓度不同不能比较![]() 存在对化学反应速率的影响
存在对化学反应速率的影响
C. 图丙表明,![]() 作催化剂时,浓度越大催化
作催化剂时,浓度越大催化![]() 分解效果越好
分解效果越好
D. 图乙和图丙表明,相同条件下对![]() 分解速率受
分解速率受![]() 影响大
影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某十钒酸铵[(NH4)xH6-xV10O28·yH2O(其中钒为+5价)]常用来制造高端钒铝合金。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
(1) NH4+含量测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
(2) V10O![]() (M=958 g·mol-1)含量测定
(M=958 g·mol-1)含量测定
步骤1:准确称取0.3636 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O![]() 完全转化为VO2+。
完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:____________________________________。
②若未进行步骤3操作,则数值y将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1)某学生在实验室用密度为1.15g/mL,质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积___________________ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是__________________________________________________________________________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________________________________________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、“ 偏低”或“无影响”)?
a. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_____________________;
b. 转移溶液时,不慎有少量溶液洒在容量瓶外___________________________;
c.量取15%的工业品过氧乙酸时,仰视量筒___________________________________;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线____________。
(4)下列叙述正确的是__________________(填字母)。
A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如右图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_________________________________________________________________________________________。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-请选择下列试剂按照加入先后顺序填空_________________________(试剂不必选完,填序号)。
①盐酸②醋酸钡溶液③氯化钡溶液④醋酸⑤碳酸钠溶液⑥碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
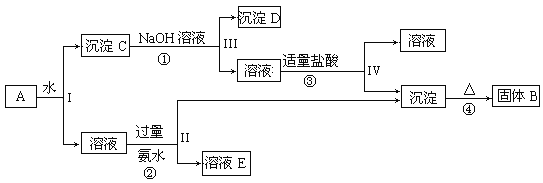
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___________。
(2)写出①、②、③离子方程式④化学反应方程式
①____________________________;②___________________________;
③____________________________;④____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期四种主族元素X、Y、Z、Q在周期表中的位置如图所示。X、Y、W的最外层电子数之和与Q原子核内质子数相等。下列说法中不正确的是( )
X | Y | ||
Z | Q | ||
W |
A. 离子半径![]() :r(Wm-)>r(Qm-)>r(Zn-)
:r(Wm-)>r(Qm-)>r(Zn-)
B. 元素Z和Y的化合价都可能存在![]() 价
价
C. 可以推测HWO4是W的最高价氧化物的水化物
D. X元素的氢化物种类繁多,大多可以与W元素的单质发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com