
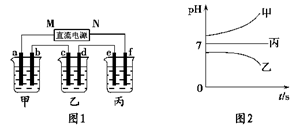
(10分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
(1)负 4OH--4e-===2H2O+O2↑ (2)2.8L
(3) 2Cu2++2H2O 2Cu+4H++O2↑ (4)向丙烧杯中加4.5 g水
2Cu+4H++O2↑ (4)向丙烧杯中加4.5 g水
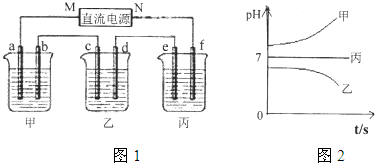
解析试题分析:(1)乙中c电极质量增加,说明乙属于阴极,所以b是阳极,a是阴极。则M是负极,N是正极,f是阳极,e是阳极,b是阳极。根据电解后溶液pH的变化可知甲中的电解质是NaOH或KOH,乙中的电解质是CuSO4,丙中的电解质是K2SO4或Na2SO4,所以b电极上发生的电极反应为4OH--4e-=2H2O+O2↑。
(2)乙中的电解质是CuSO4,c电极质量增加了16 g,说明生成了16g Cu,因此转移电子数为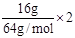 = 0.5mol,因此产生O2的体积为
= 0.5mol,因此产生O2的体积为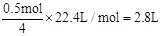 。
。
(3)乙烧杯中发生的总反应为2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
(4)因为丙烧杯中电解过程从溶液中出来的是0.25molH2和0.125mol氧气,所以需要加入0.25mol的水可以恢复到原来状态,则水的质量为4.5g。
考点:电解原理
点评:电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com