
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为___________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_______________。
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。
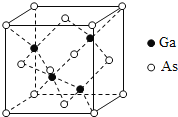
【答案】[Ar]3d104s24p3大于小于三角锥形sp3GaF3为离子晶体,GaCl3为分子晶体原子晶体共价
【解析】
(1)根据核外电子排布规律,基态As原子的核外电子排布式为[Ar]3d104s24p3。
(2)根据元素周期律,Ga和As为同一周期的两种元素,且Ga的原子序数小于As,因此原子半径Ga大于As,第一电离能Ga小于As。
(3)AsCl3分子中砷原子价电子有4对,其中3个成键电子对、1个孤电子对,因此其分子的立体构型为三角锥形,As的杂化轨道类型为sp3杂化。
(4)由题意可知GaF3的熔点远远高于GaCl3,其原因为GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3熔沸点更高。
(5)GaAs晶体的熔点很高,可以判断该晶体类型为原子晶体;Ga与As以极性共价键键合。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某化学课外活动小组利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
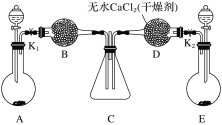
(1)A和E中制取NH3的装置为_____,所用试剂为___,装置中制取NO2的化学方程式是___________________。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是______________________。
(3)实验过程中,一段时间内未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③______________。
(4)此实验装置存在一个明显的缺陷是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
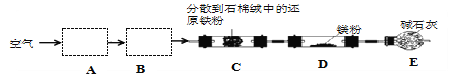
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查得N≡N键能为945.6 kJ·mol-1、H—N键能为391 kJ·mol-1。已知氮气与氢气化合生成2 mol氨气时放出的能量为92.4 kJ。则H—H键的键能是( )
A. 45 kJ·mol-1B. 436 kJ·mol-1
C. 1 308 kJ·mol-1D. 135 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质分类组合完全正确的是( )
A | B | C | D | |
酸 | HCl | H2SO4 | NaHSO4 | HNO3 |
碱 | Na2CO3 | NaOH | Fe(OH)3 | KOH |
盐 | CuSO4 | BaSO4 | NaCl | NaHCO3 |
氧化物 | H2O | KClO3 | CuO | Na2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
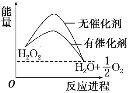
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________。

(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH。则放电时正极的电极反应式为__________。
NiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③![]() 和
和![]() ④CH3CH2CH2CH3和
④CH3CH2CH2CH3和![]()
![]() 乙烷和丁烷
乙烷和丁烷
请用序号回答下列问题:
互为同系物的是______,互为同分异构体的是______,互为同位素的是______,互为同素异形体的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com