
【题目】下列描述的离子反应方程式正确的是
A. 少量的 SO2 通入 NaClO 溶液:SO2+H2O+2ClO-=SO32-+2HClO
B. 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C. 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl―+Cl2↑+2H2O
Mn2++2Cl―+Cl2↑+2H2O
D. 等浓度的 NaHSO4 与 Ba(OH)2 混合至溶液呈中性:Ba2++2OH―+SO42―+2H+=BaSO4↓+2H2O
【答案】D
【解析】
次氯根具有较强的氧化性,能够氧化亚硫酸根离子;Fe3+能氧化碘离子;书写离子方程式中浓盐酸拆写成离子;NaHSO4与Ba(OH)2 2:1混合呈中性;
HClO能把 SO32-氧化为SO42-,少量的SO2通入NaClO溶液,离子方程式是SO2+H2O+3ClO-=SO42-+Cl-+2HClO,故A错误;氧化铁溶于氢碘酸的离子反应为Fe2O3+2I-+6H+═2Fe2++I2+3H2O,故B错误;用二氧化锰和浓盐酸反应制氯气:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故C错误;NaHSO4与Ba(OH)2 2:1混合呈中性,离子方程式是Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D正确。选D。
Mn2++Cl2↑+2H2O,故C错误;NaHSO4与Ba(OH)2 2:1混合呈中性,离子方程式是Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D正确。选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某药物分子结构简式如下图所示,下列关于该物质的说法正确的是( )

A. 分子式为C21H22O3Cl2
B. 醚键上的氧原子至少与另外11个原子共面
C. 分子中不存在手性碳原子
D. 在一定条件下可发生加成.取代.氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,有关该有机物的说法不正确的是

A. 该有机物的分子式为 C20H14O4
B. 该有机物分子中所有的原子不可能处于同一平面
C. 1mol 该有机物分别与 Br2、NaOH 反应, 最多能消耗 4molBr2、4molNaOH
D. 该有机物能发生加成、取代、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体175℃分解成CO2、CO、H2O,请写出草酸晶体分解的化学反应方程式:_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量CO气体,最佳的连接顺序为:________。(填字母序号)
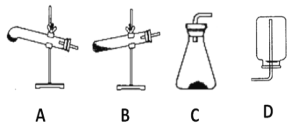
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL。
(4)现需要配制900mL1mol/L的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、_________、__________(填仪器名称)。
②下列操作会使所配溶液浓度偏低的是__________。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____________________________________________。
②量取KMnO4样品溶液应选用__________(填“酸式”或“碱式”)滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,则最终的测定结果将________(填“偏大”、“偏小”或“不变”)。
③现取KMnO4粗品10g,配成100mL溶液,取25.0 mL用(4)中配制的草酸溶液滴定,并进行3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,请问KMnO4粗品的质量分数为______________。(已知:KMnO4的摩尔质量为158g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
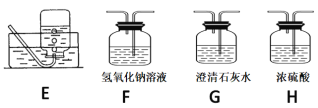
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒加SO2等辅料,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.氧化细菌 B.抗氧化 C.漂白 D.增酸作用
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:

(2)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3。这个结论____(填“成立”或“不成立”),理由是______。
Ⅱ.实验方案二
(3)用如图实验装置探究二氧化硫的氧化性。

充入气体前的操作为___,关闭旋塞1和2;按图2充入气体,连接装置。打开旋塞1,可观察到的主要现象是_____;若A瓶和B瓶的体积相等,恢复到常温,打开旋塞2,可观察到的现象是____,此时A瓶中可能发生反应的化学方程式为____。
(4)从环保角度,利用图2装置设计探究二氧化硫既有氧化性又有还原性的最佳方案。
实验方案 | 预期现象 |
将烧杯中的氢氧化钠溶液换成_____溶液(填化学式),操作如(3) | 说明SO2具有还原性的现象为____,对应的离子方程式为:_____________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com