
【题目】氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用。
(1)液氨储氢是目前研究的重要课题。液氨的电离和水的电离相似,液氨中的氨也能发生电离:NH3+NH3![]() NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
(2)用Pt电极对液氨进行电解可产生H2和N2,则阴极的电极反应式是 。
(3)用NH3催化还原NXOy可以消除氮氧化合物的污染。请写出氨气催化还原NO的化学方程式 。
(4)将一定量的N2和H2充入1L的密闭容器中,在500℃、2×107Pa下反应并达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol,则H2的平衡转化率为 ;在该温度下的平衡常数K= 。

(5)右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、“=”或“<”)
【答案】(1)1.0×10-29mol/L
(2)2NH3+2e-=H2 +2NH2- 或 2NH4++2e-=H2+2NH3
(3)4NH3+6NO![]() 5N2+6H2O (4)33.3% 3.70 L2/mol2
5N2+6H2O (4)33.3% 3.70 L2/mol2
(5)>
【解析】
试题分析:(1)将2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑;促进液氨的电离,依据:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30;反应生成NH2-物质的量为0.1mol;浓度为0.1mol/L,所得溶液中NH4+的浓度l.0×l0-29mol/L。
(2)用Pt电极对液氨进行电解可产生H2和N2,阴极得到电子,发生还原反应,则阴极是铵根放电生成氢气,电极反应式是2NH3+2e-=H2 +2NH2- 或 2NH4++2e-=H2+2NH3。
(3)氨气催化还原NO生成氮气和水,反应的化学方程式为4NH3+6NO![]() 5N2+6H2O。
5N2+6H2O。
(4)将一定量的N2和H2充入1L的密闭容器中,在500℃、2×107Pa下反应并达到平衡,测得N2为0.10 mol ,H2为0.30 mol ,NH3为0.10 mol ,则根据方程式N2+3H2![]() 2NH3可知消耗氢气是0.15mol,则H2的平衡转化率为
2NH3可知消耗氢气是0.15mol,则H2的平衡转化率为![]() ;在该温度下的平衡常数K=
;在该温度下的平衡常数K=![]() 。
。
(5)由于正反应是放热反应,升高温度平衡向逆反应方向进行,氨气的含量降低,所以a曲线是平衡曲线,b曲线是经过一定时间反应后的曲线,b点随温度的升高氨气的含量升高,说明反应向正反应方向进行,因此v(正)>v(逆)。


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. FeC12溶液中通人Cl2:Fe2++Cl2=2Cl-+Fe3+
B. 铝和烧碱溶液:2Al+2OH-+2H2O =AlO2-+3H2↑
C. Fe投人盐酸中:2Fe+6H+=2Fe3++3H2↑
D. 氯化铝溶液中加人足量的氨水:Al+3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO;PbO+CO
Pb+CO;PbO+CO![]() Pb+CO2.下列说法正确的是( )
Pb+CO2.下列说法正确的是( )
A.将1 mol PbS冶炼成Pb理论上至少需要6 g碳
B.浮选法富集方铅矿的过程属于化学变化
C.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D.整个冶炼过程中,制取1 mol Pb共转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普及化学知识有助于人们树立健康的观念。下列观念正确的是( )
A.天然物质都是绿色无毒的物质
B.只饮用纯净水有益人体健康
C.禁止吸烟可减少室内空气污染
D.微量元素只能通过保健品摄入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁[Fe3(PO4)2·8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇。主要用于制造磷酸铁锂电池。实验室制备磷酸亚铁的装置示意图、

反应和实验步骤如下。主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2·8H2O↓+3Na2SO4+2CH3COOH
实验步骤:①在仪器A中先加入抗坏血酸(C6H8O6)稀溶液作底液②向仪器A中,滴入Na2HPO4与CH3COONa混合溶液至pH=4 ③滴入15.2克FeSO4溶液,最终维持pH=6,充分反应后,静置④进行操作a,干燥得到的磷酸亚铁12.8克。
(1)仪器A的名称是 。
(2)实验中配制FeSO4溶液时,先要对蒸馏水进行的操作是 。
(3)实验中不是将三种溶液直接混合的原因是 ,反应时需不断搅拌,其目的是 。
(4)步骤④进行的操作a是 。
(5)检验磷酸亚铁粗产品中是否混有氢氧化铁杂质的方法是 。
(6)本实验的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
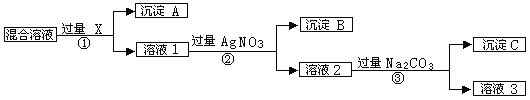
(1)写出下列物质的化学式X 、A __ 、B __
(2)上述实验流程中加入过量的Na2CO3的目的是_______________________。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应aA(g)+bB(g)![]() cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:
cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:![]() =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)若升高温度到950℃,达到平衡时K________(填“大于”、“小于”或“等于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com