
下列有关周期表的叙述中正确的是
| A.碱土金属元素是指ⅡA族的所有元素 |
| B.除第一周期外,其他周期均有18种元素 |
| C.过渡元素都是副族元素 |
| D.主族元素的原子,半径越大,越容易得到电子 |
科目:高中化学 来源: 题型:单选题
短周期中的A、B、C、D、E五种元素,原子序数依次增大。A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2—与D+的核外电子数相等。则下列说法正确的是
A.B与A只能组成BA3化合物
B.C、D、E形成的化合物水溶液可能显碱性
C.A、B、C形成的化合物一定不能发生水解反应
D.E的氧化物对应的水化物只具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | —— | -3 | -2 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在短周期元素中,A元素的最高正化合价和最低负化合价的绝对值之差为6,A元素与B元素可以形成化合物BA2,A的阴离子与B的阳离子具有相同的电子层结构,则该化合物是 ( )
| A.MgCl2 | B.CaCl2 | C.SiO2 | D.CS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
最近医学界通过放射性14C来标记C60的羧酸衍生物在特定条件下通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS),有关14C的叙述正确的是 ( )
| A.与C60中普通碳原子的化学性质不同 | B.与12C互为同位素 |
| C.与14N含的中子数相同 | D.是C60的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是 ( )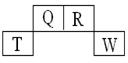
| A.H2R2的分子中既含有极性共价键,又含有非极性共价键 |
| B.Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 |
| C.T的氧化物是一种良好的半导体材料 |
| D.Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2012年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素, 该同位素原子的质量数为298。以下叙述正确的是( )
| A.该元素属于第六周期 |
| B.该元素位于第ⅢA族 |
| C.该元素为金属元素,性质与82Pb相似 |
| D.该同位素原子含有114个电子,185个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列判断正确的是
| A.根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角只能是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键。下列说法不正确的是
| A.沸点:W2R>W2Q | B.P与R形成化合物中,阴、阳离子个数比一定为1:2 |
| C.原子半径:W<R<Q<P | D.Q元素形成的酸一定是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com