
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
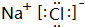 .
.分析 由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强,非金属性减弱,稀有气体最外层为稳定结构,化学性质最不活泼;
(2)元素的最高价氧化物对应的水化物中酸性最强的是高氯酸,氢氧化铝是两性氢氧化物;
(3)同主族自上而下金属性增强,非金属性减弱;非金属性越强,氢化物越稳定;
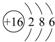
(4)⑥为S,原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(5)元素④与⑦的化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程;
(6)钠与水反应生成氢氧化钠与氢气;
(7)元素④、⑤的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强,非金属性减弱,最活泼的金属元素是Na,最活泼的非金属元素是F,稀有气体Ar原子最外层为稳定结构,化学性质最不活泼
故答案为:Na;F;Ar;
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,氢氧化铝是两性氢氧化物,能形成两性氢氧化物的元素是Al,
故答案为:HClO4;Al;
(3)同主族自上而下金属性增强,非金属性减弱,故非金属性②>⑥,非金属性越强⑥<⑦,氢化物越稳定⑥<⑦,
故答案为:大于;小于;
(4)⑥为S,原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为 ,
,
故答案为:S; ;
;
(5)元素④与⑦的化合物为NaCl,由钠离子与氯离子构成,电子式为: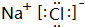 ,
,
故答案为: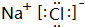 ;
;
(6)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(7)元素④、⑤的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O.
点评 本题考查学生元素周期律和元素周期表的综合应用,侧重常用化学用语、元素周期律的考查,难度不大,注意基础知识的理解掌握.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 当分子式中的x≤4时,上述烃在常温常压下均为气体 | |
| B. | 分子式中的y一定为偶数 | |
| C. | 1mol的上述烃完全燃烧时,耗氧($\frac{x+y}{4}$)mol | |
| D. | 150℃时,在密闭的容器中完全燃烧后,测得的压强一定比燃烧前增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量等于NA个氯化氢分子的质量 | |
| B. | 常温常压下1mol二氧化碳的体积大于22.4L | |
| C. | 64g金属铜发生氧化反应,一定失去2NA个电子 | |
| D. | 62g氧化钠溶于水后,所得溶液中含有NA个O2-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液中有电离出的自由移动的离子 | |
| B. | 有导线将两个活泼性不同的电极连接 | |
| C. | 在不同金属的两极间存在电势差 | |
| D. | 在原电池中发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
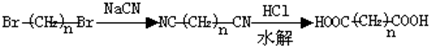 现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下:
现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下: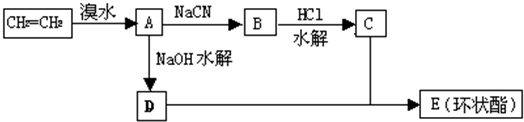
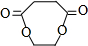 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
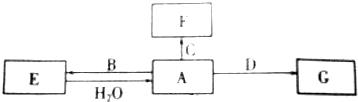
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石头纸(主要成分CaCO3)代替普通纸,减少对木材的使用 | |
| B. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺的状况 | |
| C. | 将秸秆充分燃烧,避免秸秆腐烂造成环境污染 | |
| D. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的金属性比镓强,铝的熔点比镓低 | |
| B. | 铝表面形成致密的氧化膜,所以可以用铝制容器来腌制咸菜 | |
| C. | Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应 | |
| D. | 铝镓合金与水反应后的物质可以回收利用冶炼铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com