
【题目】下列说法正确的是( )
A. 原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素
B. 原子最外层只有1个电子的元素一定是金属元素
C. 最外层电子数比次外层电子数多的元素一定位于第二周期
D. 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:

已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为___________。
(2)根据实验目的,选择合适的实验步骤:①→____________。
①组装好装置,_________________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加人冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_________________。
(4)反应完毕后,U形管内的现象是_________;分离溴乙烷时所需的玻璃仪器是___________。
(5)假设最初取用的无水乙醇是71.9 mL,最后得到的纯净的溴乙烷是66.2 mL,则溴乙烷的产率为______________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的鉴别中,所选用的试剂及产生的现象不完全正确的是( )
选项 | 有机物 | 试剂 | 现象 |
A | 乙烯 | 溴水 | 橙色褪去 |
B | 葡萄糖 | 新制氢氧化铜悬浊液 | 出现红色沉淀 |
C | 淀粉 | 碘水 | 出现蓝色沉淀 |
D | 蛋白质 | 浓硝酸 | 呈黄色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见药物的用途不正确的是
A. 阿司匹林具有治疗胃酸过多的作用
B. 青霉素有阻止多种细菌生长的功能
C. 麻黄碱具有止咳平喘作用
D. 医疗上用少量鸦片作止泻、镇痛剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E元素形成的氧化物对应的水化物的化学式为_______________________________。
(2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。
(4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO![]() 的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 1L0.1mol·L-1CH3COOH溶液中含H+的数目为0.1NA
B. 标准状况下,2.24LCl2 溶于水,转移的电子数为0.1NA
C. 100g质量分数为46%的酒精溶液中含氧原子总数为4NA
D. 常温下,将1molFe加入足量硝酸中,生成H2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
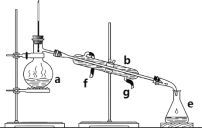
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
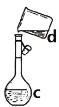
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为_______。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;容量瓶用蒸馏洗涤后残留有少量的水_____________;若定容时俯视刻度线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com