
【题目】下列物质中,只含有非极性共价键的是( )
A.NaOH
B.NaCl
C.H2
D.H2S
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000molL﹣1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 .
(2)盛装标准盐酸的仪器名称为 .
(3)滴定至终点的颜色变化为 .
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 . 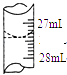
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字).
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL﹣1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
① | 25.00 | 0.00 | 26.29 |
② | 25.00 | 1.00 | 31.00 |
③ | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,22.4L苯中含有的碳氢键数目为6NA
B. 标准状况下,22.4LNO与11.2L 的O2组成的混合气体中含有的原子数为3NA
C. 25℃时,pH=1的CH3COOH溶液中含有的H+数目等于0.1NA
D. 已知反应: Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移的电子数为2NA
2Cu+SO2,每生成1molCu转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲,乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T3 |
起始量 | 1molCO2(g) 2molCH3OH(g) | 1molDMC(g) 1molH2O(g) | 2molCO2(g) 2molCH3OH(g) |
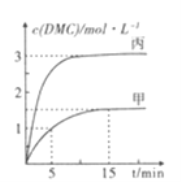
甲容器中,在5-15min时的平均反应速率v(CO2)=___________.乙容器中,若平衡时n(CO2)=0.2mol.则T1_____T2 (填“>”“<”或“=”)。两容器的反应达平衡时CO2的转化率: 甲________丙(填“>”“<."或”=”)。
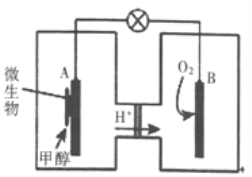
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示: A极是_____极(填“正”或“负”),其电极反应式是_______。该电池不能在高温下工作的理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的叙述中,正确的是( )
A.Na2O、Na2O2都属于碱性氧化物
B.钠着火时可用干冰灭火
C.Na2O、Na2O2水溶液的成分相同
D.向碳酸钠固体中滴加少量水,伴随着吸热现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2).为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验. 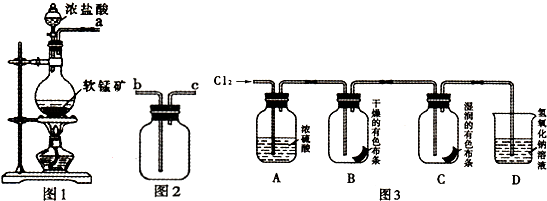
【查阅资料】MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是 .
(2)收集氯气应将图1导管的a接口与图2导管的接口连接(填“b”或“c).
(3)若生成标准状况下11.2L Cl2 , 则参加反应的MnO2的物质的量为 mol.
(4)【实验探究】 把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟.反应的化学方程是 .
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色.由此得出的结论 .
(6)写出C中反应的化学方程式: .
(7)【联系实际】 某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是 (填序号).
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 纤维素![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 淀粉![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
D. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是
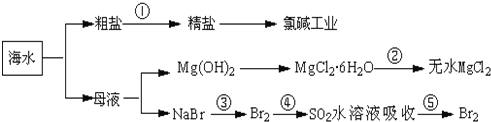
A. 除去粗盐中杂质Mg2+、SO42-、Ca2+,加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
C. 从第③步到第⑤步的目的是为了浓缩
D. 在过程④中SO2被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备. 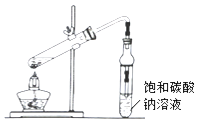
完成下列填空:
(1)铁架台上的试管中发生的反应方程式是 .
(2)饱和Na2CO3溶液的作用是 .
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,、 , 然后分液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com