
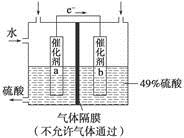
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.该电池为可充电电池 |
| B.电子移动方向:电极a→磷酸溶液→电极b |
| C.正极反应式为:CH2=CH2-2e- + 2OH- → CH3CHO + H2O |
| D.每有0.1mol O2反应,则迁移H+ 0.4mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
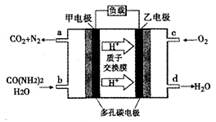
| A.电池工作时H+ 移向负极 |
| B.该电池用的电解质溶液是KOH溶液 |
| C.甲电极反应式为:CO(NH2 )2 +H2O - 6e-= CO2 +N 2 + 6H+ |
| D.电池工作时,理论每有净化1mol CO(NH2 )2,消耗 33.6 L O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极反应:O2 + 2H2O + 4e- ="==" 4OH- |
| B.当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) |
| C.发生氧化反应的是负极 |
| D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O |
| B.该电池充电时,阴极发生了氧化反应:Li++e-===Li |
| C.电池中的有机电解液可以用稀盐酸代替 |
| D.正极区产生的LiOH可回收利用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
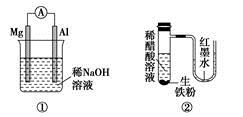
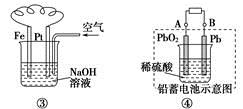
| A.图①铝片发生的电极反应式是:Al+4OH--3e-===AlO2-+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+===Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-===PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
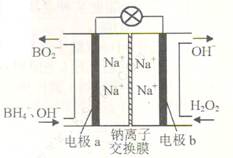
| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗6molH2O2转移电子6mol |
| C.电极a采用MnO2,MnO2既作电极又有催化作用 |
| D.该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
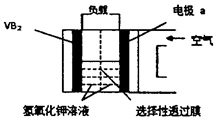
| A.电极a是电源负极 |
| B.溶液中的OH-向a极移动 |
| C.电子由VB2极经KOH溶液流向电极a |
| D.VB2极发生的电极反应为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com