
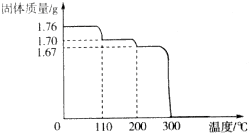

分析 Ⅰ.(1)依据1.76gHIO3全部失水时剩余固体质量,结合图象中固体变化和温度变化分析判断;
(2)200°C-300°C是I2O5分解后无固体剩余,则分解产物为I2和O2;
Ⅱ.(3)I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,用I2O5测定空气中CO的含量,需要依据此反应生成产物出现的现象和质量变化,计算一氧化碳的含量,所以空气先通过装置B中氢氧化钠溶液吸收空气中的二氧化碳,防止干扰测定含量,I2O5为白色固体,易吸水,所以再通过装置A中的浓硫酸干燥气体,通入装置D和)I2O5反应,生成的二氧化碳可以利用装置C吸收气体二氧化碳前后的质量变化计算;
(4)装置B中氢氧化钠是除去空气中的二氧化碳;
(5)分析可知,装置D中发生反应I2O5+5CO=I2+5CO2,生成紫黑色固体碘单质;
(6)测得在0-tmin内C装置中生成沉淀质量为mg为BaCO3,是一氧化碳和I2O5反应生成的二氧化碳,物质的量n(BaCO3)=n(CO2)=n(CO)=$\frac{mg}{197g/mol}$=$\frac{m}{197}$mol,空气的体积为V0mL/min×tmin=V0tml=V0t×10-3L,n(空气)=$\frac{{V}_{0}t×1{0}^{-3}L}{{V}_{m}L/mol}$=$\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}$mol,计算得到空气中CO的体积分数,某同学认为上述方法存在误差的原因可能是生成的二氧化碳未被氢氧化钡溶液全部吸收;
解答 解:Ⅰ.(1)2HIO3$\frac{\underline{\;\;△\;\;}}{\;}$I2O5+H2O
2×176 18
1.76g x
x=0.09g
图象可知200°C时固体质量减少1.76g-1.67g=0.09g,说明此时已全部失水,
故答案为:是;2HIO3$\frac{\underline{\;\;△\;\;}}{\;}$I2O5+H2O
2×176 18
1.76g x
x=0.09g
图象可知200°C时固体质量减少1.76g-1.67g=0.09g,说明此时已全部失水;
(2)图象分析可知,依据(1)减少可知200°C-300°C是I2O5分解后无固体剩余,则分解产物为I2和O2,反应的化学方程式为:2I2O5$\frac{\underline{\;\;△\;\;}}{\;}$2I2↑+5O2↑,
故答案为:2I2O5$\frac{\underline{\;\;△\;\;}}{\;}$2I2↑+5O2↑;
Ⅱ.(3)I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,用I2O5测定空气中CO的含量,需要依据此反应生成产物出现的现象和质量变化,计算一氧化碳的含量,所以空气先通过装置B中氢氧化钠溶液吸收空气中的二氧化碳,防止干扰测定含量,I2O5为白色固体,易吸水,所以再通过装置A中的浓硫酸干燥气体,通入装置D和)I2O5反应,生成的二氧化碳可以利用装置C吸收气体二氧化碳前后的质量变化计算,依据步骤可知装置连接顺序为:cdabghfe,
故答案为:cdabghfe;
(4)装置B中氢氧化钠是除去空气中的二氧化碳,
故答案为:吸收通入空气中的二氧化碳气体;
(5)分析可知,装置D中发生反应I2O5+5CO=I2+5CO2,生成紫黑色固体碘单质,
故答案为:D中固体部分变为紫黑色;
(6)测得在0-tmin内C装置中生成沉淀质量为mg为BaCO3,是一氧化碳和I2O5反应生成的二氧化碳,物质的量n(BaCO3)=n(CO2)=n(CO)=$\frac{mg}{197g/mol}$=$\frac{m}{197}$mol,空气的体积为V0mL/min×tmin=V0tml=V0t×10-3L,n(空气)=$\frac{{V}_{0}t×1{0}^{-3}L}{{V}_{m}L/mol}$=$\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}$mol,
空气中CO的体积分数=$\frac{\frac{m}{197}mol}{\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}mol}$×100%=$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%,某同学认为上述方法存在误差的原因可能是生成的二氧化碳未被氢氧化钡溶液全部吸收,
故答案为:$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%;反应生成的二氧化碳没有完全被氢氧化钡溶液吸收;
点评 本题考查了物质组成的实验探究方法和构成分析判断,主要是物质性质、实验装置连接和装置中试剂作用的分析应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
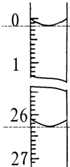 某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:
某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=26.20 |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
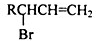
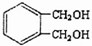 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式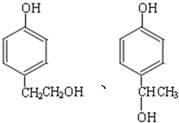 (其中之一);
(其中之一);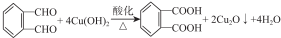 ;
;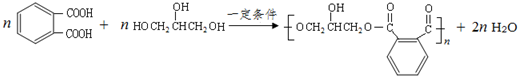 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 含有大量ClO-的溶液中:K+、H+、I-、SO42 | |
| C. | -使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钙 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
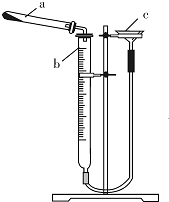 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
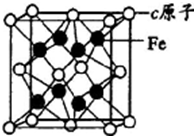 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
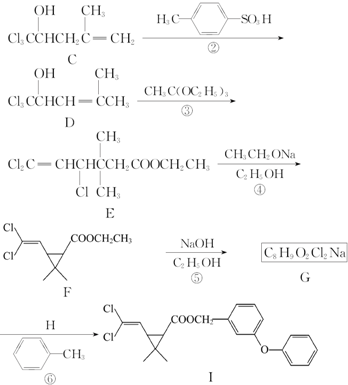
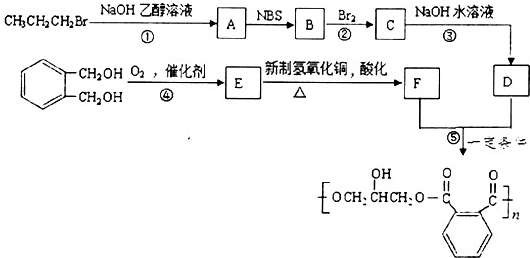
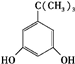 、
、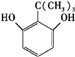 、
、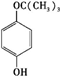 任意一种.
任意一种.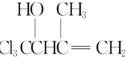 为原料合成
为原料合成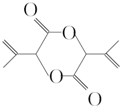 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
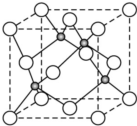 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com