
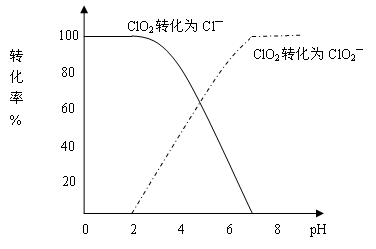
 完全还原成Cl—,那么I-要被氧化为碘单质,溶液是酸性溶液,则可正确写出离子方程式即反应的离子方程式是ClO2-+4I-+4H+=Cl-+2H2O+2I2。
完全还原成Cl—,那么I-要被氧化为碘单质,溶液是酸性溶液,则可正确写出离子方程式即反应的离子方程式是ClO2-+4I-+4H+=Cl-+2H2O+2I2。 4Fe3++Cl-+4OH-,Fe3++ OH-
4Fe3++Cl-+4OH-,Fe3++ OH- Fe(OH)3可知,氧化产物为Fe(OH)3。
Fe(OH)3可知,氧化产物为Fe(OH)3。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐升高 |
| B.单质和水反应通式是:X2 + H2O=HX + HXO,剧烈程度随着核电荷数的增多而减弱。 |
| C.单质和氢气反应的通式是:X2 + H2= 2HX(条件不同),剧烈程度随着卤素核电荷数的增多而减弱,所生成的氢化物的稳定性降低 |
| D.随着卤素核电荷数的增多,单质的氧化性逐渐增强,阴离子还原性逐渐减弱 |
查看答案和解析>>
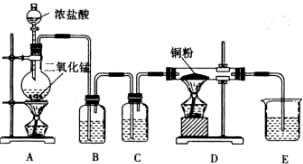
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用氯气的毒性 | B.利用氯气与水反应生成的HClO具有强氧化性 |
| C.利用 氯气的漂白性 | D.利用氯气与水反应生成的HCl具有强酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气、液氯和氯水是同一种物质,只是状态不同,都属于纯净物 |
| B.氯气是纯净物,氯水是混合物 |
| C.铁丝在氯气中燃烧生成黄色固体FeCl2 |
| D.新制的氯水只含有氯气分子和水分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCl+HIO。 下列关于ICl的叙述中不正确的是( )
HCl+HIO。 下列关于ICl的叙述中不正确的是( )| A.ICl是一种有色物质 |
| B.在许多反应中ICl是强氧化剂 |
| C.在ICl与水的反应中,它既是氧化剂又是还原剂 |
| D.与NaOH溶液反应生成的产物中有NaIO和NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Zn | B.Na、Zn | C.Fe、Ca | D.Cu 、Ca |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制氯水只含有氯分子和次氯酸分子; |
| B.新制氯水可使紫色石蕊试液先变红后褪色; |
| C.氯水光照时有气泡逸出,该气体的主要成分是氯气; |
| D.氯水放置数天后,其酸性逐渐减弱。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com