
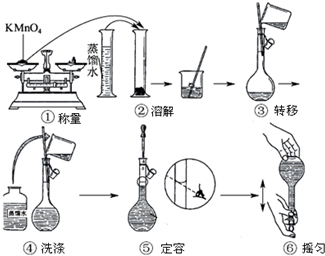
分析 (1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)容量瓶是确定溶液体积的仪器;
(3)依据仰视刻度线,会使溶液体积偏大判断,结合C=$\frac{n}{V}$分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒和根据电荷守恒进行分析写出化学方程式得到x;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答 解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,故答案为:②⑤;
(2)应该用容量瓶准确确定100mL溶液的体积,故答案为:容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,故答案为:偏小;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:$\frac{0.024g}{20cm{\;}^{3}}$=1.2 mg/cm3,
故答案为:1.2.
点评 本题考查了配制一定物质的量浓度的方法及误差分析,题目难度不大,注意掌握配制一定浓度的溶液的方法及误差分析方法及技巧.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应的离子方程式:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与CuSO4溶液反应的离子方程式:2Na+Cu2+═Cu↓+2Na+ | |
| C. | NaHCO3溶液与NaOH反应的离子方程式:HCO3-+OH-═H2O+CO2↑ | |
| D. | 将CO2通入饱和碳酸钠溶液直至过量的离子方程式:2Na++CO2+CO32-+H2O═2NaHCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的溶液导电能力强于弱电解质的溶液 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | 所有盐均电离出金属阳离子和酸根离子 | |
| D. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁是混合物,钢是纯净物 | |
| B. | 用铁矿石来炼铁时,要加入如焦炭等氧化剂 | |
| C. | 不锈钢是铁和硅的合金,比纯铁硬度大,不易腐蚀 | |
| D. | 钢比生铁含碳量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:5 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Brˉ、CO32ˉ | B. | Clˉ、NO3ˉ、Fe2+、H+ | ||
| C. | K+、Na+、SO42ˉ、MnO4ˉ | D. | Na+、H+、SO42ˉ、HCO3ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com