


| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |

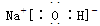 (2分)、
(2分)、 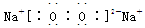 (2分) B (2分)
(2分) B (2分)

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.电子层结构相同的微粒,其化学性质一定相似 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+1s22s22p63s23p6 | B.As 1s22s22p63s23p63d104s24p3 |
| C.N3-1s22s22p6 | D.Cr 1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
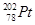 的说法正确的是
的说法正确的是A.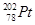 和 和 的质子数相同,互称为同位素 的质子数相同,互称为同位素 |
B.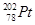 和 和 的中子数相同,互称为同位素 的中子数相同,互称为同位素 |
C.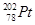 和 和 的核外电子数相同,是同一种核素 的核外电子数相同,是同一种核素 |
D.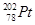 和 和 的质量数不同,不能互称为同位素 的质量数不同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com