
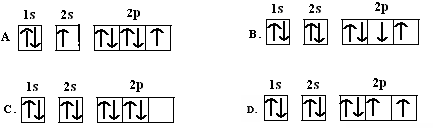
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等体积、等密度的CO和C2H4所含原子数相等 |
| B.Na218O2与水反应生成氧气的相对分子质量为34 |
| C.OD-中所含电子数和中子数相等 |
| D.用NH3+H3O+=NH4++H20可以证明NH3比H2O结合质子的能力强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所用金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
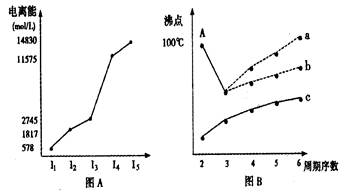
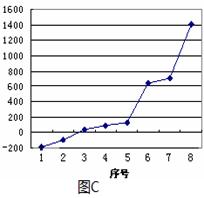
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A | | | |
| | | B | C |
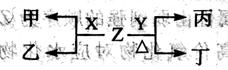
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cn
Cn Cn与
Cn与 Cn互为同位素,二者中子数之差为8
Cn互为同位素,二者中子数之差为8查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com