
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
周期\族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑤、⑥、⑦的原子半径由大到小的顺序为_________________(填元素符号)。它们的最高价氧化物对应水化物的碱性从强到弱的顺序为______________(填最高价氧化物对应水化物的化学式)。
(2)②、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是__________________(填最高价含氧酸的化学式)。
(3)①、④、⑤三种元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:__________________。
(4)由表中①、④两种元素的原子可按1∶1组成的一种常见液态化合物。此液态化合物的电子式为:__________________。请写出此液态化合物在MnO2催化作用下分解的化学方程式____________
(5)⑧是极好的半导体材料,而且能与③在高温的条件下生成一种优良的新型陶瓷材料,请写出这个反应的化学方程式:__________________。
【答案】 Na > Mg > Al NaOH > Mg(OH)2 > Al(OH)3 HClO4 > H2CO3 > H2SiO3 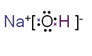
![]() 2H2O2
2H2O2 ![]() 2H2O + O2↑ 3Si + 2N2
2H2O + O2↑ 3Si + 2N2![]() Si3N4
Si3N4
【解析】根据元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Mg,⑦为Al,⑧为Si,⑨为Cl。
(1)同一周期,从左到右,原子半径逐渐减小,最高价氧化物对应水化物的碱性逐渐减弱,⑤、⑥、⑦的原子半径由大到小的顺序为Na > Mg > Al,它们的最高价氧化物对应水化物的碱性从强到弱的顺序为NaOH > Mg(OH)2 > Al(OH)3,故答案为:Na > Mg > Al;NaOH > Mg(OH)2 > Al(OH)3;
(2)元素的非金属性越强,最高价含氧酸的酸性越强,②、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4 > H2CO3 > H2SiO3,故答案为:HClO4 > H2CO3 > H2SiO3;
(3) H、O、Na三种元素可形成既含离子键又含极性共价键的化合物可以是氢氧化钠,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)H、O两种元素的原子可按1∶1组成的一种常见液态化合物是过氧化氢,电子式为![]() ,过氧化氢在MnO2催化作用下分解的化学方程式为2H2O2
,过氧化氢在MnO2催化作用下分解的化学方程式为2H2O2![]() 2H2O + O2↑,故答案为:
2H2O + O2↑,故答案为:![]() ;2H2O2
;2H2O2![]() 2H2O + O2↑;
2H2O + O2↑;
(5) Si与N在高温的条件下生成一种优良的新型陶瓷材料,反应的化学方程式为3Si + 2N2![]() Si3N4,故答案为:3Si + 2N2
Si3N4,故答案为:3Si + 2N2![]() Si3N4。
Si3N4。


科目:高中化学 来源: 题型:
【题目】实验室通常用下图所示的装置来制取氨气。回答下列问题:

(1)写出反应的化学方程式:__。
(2)待氨气生成后,将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是____________________。
(3)除氨气外,还可以用该装置制取的常见气体是___________________ 。
(4)氨气极易溶于水,其水溶液显弱碱性,则氨水中除H2O、H+外还存在哪些分子和离子__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法会对人体健康造成较大危害的是( )
A.用大量SO2漂白银耳
B.用小苏打(NaHCO3)焙制糕点
C.硅胶常用作食品、药品干燥剂
D.用消毒液(有效成分NaClO)对餐具进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较填空(填“>”、“<”或“=”)
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,① ②
Ⅱ.比较2H2(g)+O2(g)![]() 2H2O(g) ΔH 1 2H2(g)+O2(g)
2H2O(g) ΔH 1 2H2(g)+O2(g)![]() 2H2O(l) ΔH2的反应热 ΔH1 ΔH2
2H2O(l) ΔH2的反应热 ΔH1 ΔH2
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液① ②
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH① ②
(2)Ⅴ.已知某可逆反应aA(g) + bB(g) ![]() cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b c + d
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b c + d

Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,① ②
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比 10
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2![]() 2SO3 平衡时 SO2的转化率A B
2SO3 平衡时 SO2的转化率A B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是
A.溶液与浊液:不同的本质原因是是否为无色透明
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、 NH4+、H+、 N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是( )

A. 该反应的还原剂是Cl- B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6 mol电子 D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com