
【题目】在25℃时,对于0.1mol·L-1的氨水,请回答以下问题。
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_________(填“增大”、“减小”或“不变”);
将_________(填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,此时溶液的pH_________7(填“>”、“<”或“=”),用离子方程式表示其原因______________,此时溶液中各离子浓度由大到小的顺序为_______________。
(3)若向氨水中加入0.05molL-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1_________V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式______________________。
【答案】(1)增大;
(2)小于;NH4++H2O![]() NH3·H2O+H+;c(NH4+)>c(SO42-)>c(H+)>c(OH-)
NH3·H2O+H+;c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(3)大于;c(NH4+)+c(H+)=2c(SO42-)+c(OH-)
【解析】
试题分析:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,故答案为:增大;
(2)pH=1的硫酸溶液,c( H +)=0.1molL-1,氢离子浓度与氨水浓度相等,体积相同,所以恰好反应生成盐,但由于硫酸铵是强酸弱碱盐,铵根离子水解,使溶液呈酸性,pH<7;如果NH4+不水解,c( NH4+):c(SO42-)=2:1,但水解是较弱的,所以c(NH4+)>c(SO42- );溶液呈酸性,所以c(H+)>c(OH-);故答案为:小于;NH4++H2O![]() NH3H2O+H+;c(NH4+)>c(SO42- )>c(H+)>c(OH-);
NH3H2O+H+;c(NH4+)>c(SO42- )>c(H+)>c(OH-);
(3)酸碱浓度比为1:2,由H2SO4+2NH3.H2O=(NH4)2SO4+2H2O得,酸碱溶液的体积比应为1:1,但由于硫酸铵是强酸弱碱盐,铵根离子水解,使溶液呈酸性,要想使溶液呈中性,加入碱液的体积要比恰好反应的大一些;无论溶液的酸碱性如何,但溶液中阴阳离子所带电荷相等,即c(NH4+)V×NA×1+c(H+)V×NA×1=c(SO42- )V×NA×2+c(OH-)V×NA×1,化简得c(NH4+)+c(H+)=2c(SO42- )+c(OH-),故答案为:大于;c(NH4+)+c(H+)=2c(SO42-)+c(OH-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.反应:aA(g) + bB(g) ![]() cC(g)△H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g)△H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
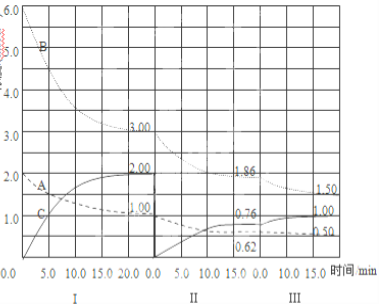
回答问题:
(1)反应的化学方程式中,a∶b∶c= 。
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ,
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。
(4)第三阶段平衡常数K3的计算式 。
Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。
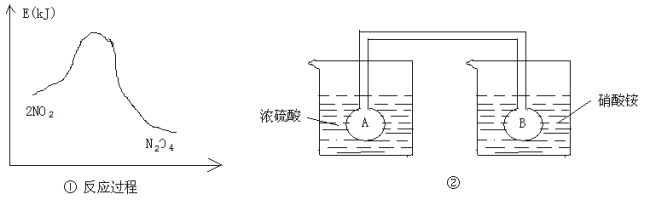
(5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质正确的是 ( )
A.分子中三个碳原子在同一直线上 B.分子中所有原子都在同一平面上
C.与HCl加成只生成一种产物 D.能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)己经被广泛应用在水处理方面,高铁酸钾的氧化性很强,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的化学过程正确的有( )
①蛋白质的变性②蛋白质的盐析③胶体聚沉④盐类水解⑤焰色反应⑥氧化还原反应
A. ①②③④ B. ①③④⑥ C. ②③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应后得到固体产物和气体,所得气体物质是: ( )
A. O2、H2O B. O2、CO2 C. O2 D. O2、H2O、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色透明溶液中能大量共存的离子组是
A. Na+、Al3+、HCO3-、NO3-
B. OH-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3-
D. Na+、NO3-、Fe3+、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。

请回答下列问题:
(1)电极X的材料是___________,电解质溶液Y是___________;
(2)银电极为电池的___________极,发生的电极反应为___________;X电极上发生的电极反应为___________。
(3)外电路中的电子是从___________电极流向_________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 0.1mol/LFeC13溶液中:A13+、NH4+、Cl-、SCN-
B. 使甲基橙变红色的溶液中:Mg2+、K+、SO42-、NO3-
C. ![]() 的溶液中:Na+、Fe3+、I-、AlO2-
的溶液中:Na+、Fe3+、I-、AlO2-
D. 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、CO32-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com