
已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是
| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硝酸,乙是浓氨水 |
科目:高中化学 来源: 题型:单选题
若NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol氦气分子中含2NA个氦原子 |
| B.在0℃、101kPa时,22.4L氢气中含有NA个氢原子 |
| C.在标准状况下,22.4L空气中约有NA个气体分子 |
| D.25℃时,l L pH=13的Ba(OH)2溶液中含 Ba2+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温下,18g H2O中含H2数目为NA |
| B.标准状况下,22. 4LH2O中含有化学键的数目为2NA |
| C.将0.5mol SO2通入足量水中,充分反应后可得到H2 SO3分子数为0.5NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学用语正确的是
A.亚硫酸氢钠溶液显酸性的原因是:HSO3-+H2O H3O++SO32- H3O++SO32- |
B.氯化铵的电子式为: |
C.钠离子的离子结构示意图为:Na  |
D.水分子比例模型为: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 
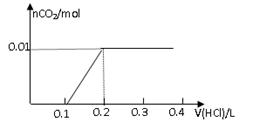
A B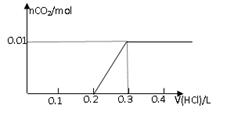

C D
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是( )
| A.溶解后的溶液未冷却至室温就转移入容量瓶中 |
| B.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平 |
| C.洗涤烧杯和玻璃棒的溶液转移入容量瓶中 |
| D.定容时,眼睛仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:
__________________________________________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_____________________,该电池总反应的离于方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com