
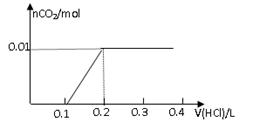
将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 
A B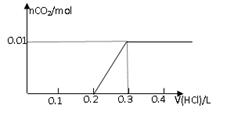

C D
D
解析试题分析:对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,有关反应的方程式分别是NaOH+HCl=NaCl+H2O、HCl+Na2CO3=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。0.8g NaOH和1.06g Na2CO3物质的量分别是0.8g÷40g/mol=0.02mol、1.06g÷106/mol=0.01mol,三步反应中消耗氯化氢的物质的量分别是0.02mol、0.01mol和0.01mol,对应盐酸的体积是0.2L、0.1L、0.1L,即盐酸的体积滴加到0.3L时开始出现气体,滴加到0.4L时气体达到最大值,因此选项D符合,答案选D。
考点:考查盐酸与氢氧化钠和碳酸钠混合液反应的计算以及图像识别等
点评:该题时高考中的常见题型,属于中等难度的试题,主要是考查了元素化合物、图象数据的处理知识。试题贴近高考,难易适中,有利于培养学生的逻辑推理能力和创新思维能力。解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
| B.1 mol硫酸钾中阴离子所带电荷数为NA |
| C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D.常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1L0.5mol·L-1 的(NH4)2SO4溶液中含NH4+数为NA |
| B.常温常压下,1molCH4中含有4NA个C-H键 |
| C.常温常压下,48g O3含有原子数为2NA(相对原子质量:O 16) |
| D.标准状况下,22.4LC6H6(苯)的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数,下列说法正确的是
| A.500mL2mol/L葡萄糖溶液中所含分子数为NA |
| B.0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA |
| C.电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2NA个电子 |
| D.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量
| A.等于2mol | B.等于1mol | C.小于1 mol | D.大于2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是
| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硝酸,乙是浓氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一质量分数为ω的KOH溶液蒸发掉m g水后,质量分数恰好变为3ω,体积为VL(溶液中无晶体析出),则浓缩后溶液的物质的量浓度为( )
A. mol·L-1 mol·L-1 | B. mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D. mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的是( )
①用电子式表示HCl的形成过程: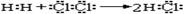
②MgCl2的电子式: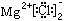
③质量数为133、中子数为78的铯原子: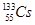
④乙烯、乙酸结构简式依次为:CH2CH2、C2H4O2
⑤S2-的结构示意图: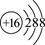
| A.①②③④⑤ | B.④⑤ | C.③④ | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com