
【题目】下列元素的原子半径最大的是( )
A.FB.ClC.BrD.I
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各粒子的物质的量浓度关系正确的是
A.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③
C.0.2 mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
D.等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO![]() )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )

A. 浓H2SO4 B. NaOH溶液 C. 澄清石灰水 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z组成的二元化合物的水溶液pH=7。下列说法错误的是

A. A与B的反应一定是化合反应
B. 离子半径:Z>X>Y>W
C. W、Y、Z均存在两种或两种以上的氧化物
D. 将等物质的量的A、C溶于同一烧杯水中,所得溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mol氩气在标准状况下的体积约为11.2 L
B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA
C. 标准状况下,11.2 L H2CO3含有的原子数为3NA
D. 常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
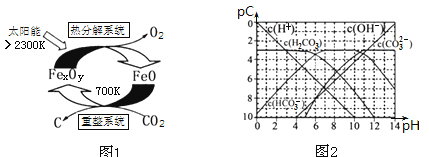
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石、石墨、C60和石墨烯都是碳的同素异形体,其结构示意图如下:
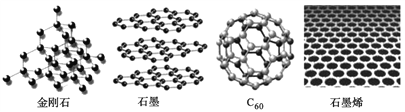
(1)石墨晶体中存在的作用力有________________________________
(2)金刚石质硬但脆,金刚石能被砸碎的原因是___________________________;金刚石、石墨、C60的熔点由高到低的顺序是________________________。
(3)C60晶体的堆积方式为______________;晶体中C60的配位数为_________。
(4)石墨烯具有神奇的特性,两位科学家由于对石墨烯研究做出重大贡献而获得了2010年诺贝尔物理学奖。石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为_______________;碳碳键的键角是_________;碳原子和碳碳键的个数比是_______;12g石墨烯中含有________个六元环。
(5)碳化硅的结构与金刚石类似,设碳化硅的密度为a g/cm3,碳化硅晶体内碳硅键的键长为______pm(用NA表示阿伏加德罗常数的值,列表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,醋酸和氨水的电离常数均为1.8×10-5。现取浓度均为0.1mol/L的醋酸溶液与氨水各20mL,分别用0.1mol/L的NaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH滴加溶液的体积变化关系如图所示。下列说法正确的是
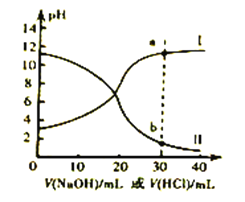
A. 曲线I中,滴加溶液到10mL时:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
B. 曲线II中,滴加溶液到20mL时: c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. 曲线II中,滴加溶液时始终存在: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D. 若将a和b两点对应的溶液混合,所得溶液常温下pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com