
| A、已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,当有3NA个电子转移时,△H变为-46.2kJ?mol-1 |
| B、1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
| C、2.9g熟石膏(2CaSO4?H2O)含有的结晶水分子数为0.01NA个 |
| D、由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| m |
| M |
| 2.9g |
| 290g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=2b |
| B、2a=b |
| C、n=0.48 |
| D、b=0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数 A>B>C |
| B、离子半径 A2->C->B2+ |
| C、原子半径 C>B>A |
| D、最外层电子数 C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的沉淀BaSO4和pH的变化关系如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的沉淀BaSO4和pH的变化关系如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大值m=2.33g |
| C、原混合液中盐酸的浓度为0.1 mol?L-1 |
| D、当V[Ba(OH)2]=10 mL时,发生反应的离子方程式为:Ba2++SO42-→BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16gCH4中含有5NA个原子 |
| B、1molNa和足量的O2在加热条件下充分反应,转移的电子数为2NA |
| C、1mol/L的Na2CO3溶液中含有2NA个Na+ |
| D、标准状况下,22.4L己烷的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3molNO2气体溶于足量水中充分反应转移的电子总数为2NA |
| B、7.8g Na2O2固体中含有的离子总数为0.4NA |
| C、标准状况下,11.2L的SO3与足量水充分反应生成的溶液中H+的总数为NA |
| D、0.5molNa在适量的氧气中燃烧生成Na2O2和Na2O,得到的电子总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
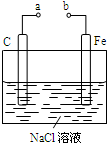
| A、a和b用导线连接,电子由碳经过导线流向铁 |
| B、a和b用导线连接,铁电极的电极反应为:Fe-3e-=Fe3+ |
| C、a、b分别连接直流电源正、负极,可以防止铁被腐蚀 |
| D、a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com