
����Ŀ����NA��������٤������������˵������ȷ���ǣ������� �ٳ��³�ѹ�£�17g������14CH3��������������Ϊ9NA
�ڳ��³�ѹ�£�22.4L NO����ķ�����С��NA
�������£�28.0g��ϩ�ͱ�ϩ�Ļ�������к��еĹ��ۼ�ԼΪ3��6.02��1023��
��7.2g CaO2�к��е���������ĿԼΪ6.02��1022
�ݱ�״��ʱ��22.4L�����������е�ԭ����Ϊ2NA
�ޱ���£�7.8g���к���̼̼˫������ĿΪ0.3NA ��
A.�٢ڢ�
B.�ڢܢ�
C.�ڢ�
D.�ݢ�
���𰸡�C
���������⣺�ٳ��³�ѹ�£�17g������14CH3�������ʵ���Ϊ�� ![]() =1mol��1mol��14CH3�к���8mol���ӣ�����������Ϊ8A���ʢٴ���
=1mol��1mol��14CH3�к���8mol���ӣ�����������Ϊ8A���ʢٴ���
�ڳ��³�ѹ�£�����Ħ���������22.4L/mol����22.4LNO�����ʵ���С�� ![]() =1mol�����еķ�����С��NA���ʢ���ȷ��
=1mol�����еķ�����С��NA���ʢ���ȷ��
�������£�28.0g��ϩ�ͱ�ϩ�Ļ�������к���28.0g���ʽCH2���������ʽ�����ʵ���Ϊ�� ![]() =2mol���������к���2molC��4molHԭ�ӣ�������ϩ�ͱ�ϩ�����У�ÿ��C��Hԭ��ƽ���γ�1�����ۼ����������к��й��ۼ���ĿԼΪ4��6.02��1023�����ʢ۴���
=2mol���������к���2molC��4molHԭ�ӣ�������ϩ�ͱ�ϩ�����У�ÿ��C��Hԭ��ƽ���γ�1�����ۼ����������к��й��ۼ���ĿԼΪ4��6.02��1023�����ʢ۴���
��7.2g CaO2�����ʵ���Ϊ�� ![]() =0.1mol��0.1mol CaO2�к���0.1mol�����Ӻ�0.1mol���������ӣ��ܹ�����0.3mol���ӣ��������ӵ���ĿΪ6.02��1022���ʢ���ȷ��
=0.1mol��0.1mol CaO2�к���0.1mol�����Ӻ�0.1mol���������ӣ��ܹ�����0.3mol���ӣ��������ӵ���ĿΪ6.02��1022���ʢ���ȷ��
�ݱ�״��ʱ��22.4L�������״̬������̬������ʹ�ñ���µ�����Ħ��������㣬�ʢݴ���
�ޱ������е�̼̼��Ϊһ�ֶ��ؼ���������в�����̼̼˫�����ʢ���
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ij�¶�ʱ����һ��10L���������У�X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
��2����Ӧ��ʼ��2min��������X��ʾ��ƽ����Ӧ����Ϊ________________��
��3��ƽ��ʱ�����������ѹǿ����ʼʱ��________________�����������������С�������������ͬ�������������ܶ�����ʼʱ��________________��
��4����amolX��bmolY�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n(X)=n(Y)=2n(Z)����ԭ���������a��b=____��
�����ں��º�ѹ���ܱ������У����������������ٷ�������ʱ���ٻ�������ѹǿ���ڻ��������ܶȣ��ۻ������������ʵ������ܻ�������ƽ����Է����������ݸ���Ӧ���������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮��
��1��һ����֤��2NO2(g)![]() N2O4(g)�ﵽƽ��״̬����________������ţ���ͬ����
N2O4(g)�ﵽƽ��״̬����________������ţ���ͬ����
��2��һ����֤��NH2COONH4(s)![]() CO2(g)+2NH3(g)�ﵽƽ��״̬����______��
CO2(g)+2NH3(g)�ﵽƽ��״̬����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�̲��г����Ľ����ͷǽ���Ԫ�ؼ��仯�����ڹ�ҵ������������ҪӦ�ã���ش��������⣺
��1���Ӻ�ˮ�������ǽ�Cl2��ͨ��Ũ��ˮ�У������嵥�ʣ������������������������������½��еģ���Ŀ���DZ���__________________��
��2��ClO2�Ǹ�Ч���Ͷ�������������ҵ����KClO3��Na2SO3��H2SO4�������Ƶ�ClO2���÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ____��
��3���ĺ������ж�����ʽ����H3 PO4 ��H3PO2�������ᣩ��H3PO3�������ᣩ����H3PO3��NaOH��Ӧֻ����Na2HPO3��NaH2PO3�����Σ�д��H3PO3�ĵڶ������뷽��ʽ_________________��H3PO3�͵�ˮ��Ӧ���ػ�ɫ��ȥ���ٵμ�AgNO3��Һ���л�ɫ�������ɣ���д��H3PO3�͵�ˮ��Ӧ�Ļ�ѧ����ʽ____��
��4���������(K2FeO4)��һ������Чˮ������������FeԪ�صĻ��ϼ���____�������������ˮ�ų���������ɱ������������������ˮ������������ʡ���һ�����ӷ���ʽ��ʾ������ش���ˮ�Ĺ���____��
��5��þһH2O2����ȼ�ϵ�صķ�Ӧ����ΪMg+H2O2 +2H+==Mg2++2H2O����������ӦʽΪ________������������ʼ�������ҺpH =1����pH =2ʱ��Һ��Mg2+Ũ��Ϊ________����֪Ksp[ Mg(OH)2]=5.6��10 -12������ҺpH =6ʱ��_____����С���û�С���Mg( OH)2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:pK=-lgK��25��ʱ����Ԫ��H2A��pK1=1.85��pK2=7.19��25��ʱ,��0.1mol/LNaOH��Һ�ζ�20mL0.1mol/LH2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ����

A. a��������Һ��:Vo=10mL
B. C��������Һ��:c(A2-)=c(HA-)
C. b��������Һ��:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d��������Һ��:A2-��ˮ��ƽ�ⳣ��K1=1��10-7.19
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯����һ����ɫ���塣������ˮ��ʵ�����Ʊ�KI����IJ�������:
I.����ͼ��ʾ��������ƿ�м���127g��ϸ�ĵ���I2��195g30%KOH��Һ������(��֪:I2��KOH��Ӧ����֮һ��KIO3)��
II.����ȫ��Ӧ��Һ©���еĻ��������ɼУ���װ��C��ͨ��������H2S��
III.��Ӧ��������װ��C�м���ϡH2SO4�ữ,ˮԡ���ȣ�
IV.��ȴ�����˵�KI����Һ��
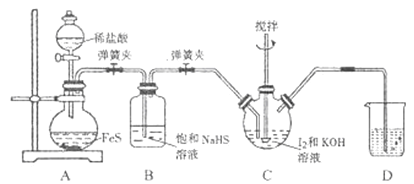
(1)���װ��A�����Եķ�����______������I����KOH��Һ������Ŀ����______��
(2)װ��B��������______��װ��D��ʢ�ŵ���Һ��______ ��
(3)д��װ��C��H2S��KIO3��Ӧ�����ӷ���ʽ: ______ ��
(4)����III��ˮԡ���ȵ�Ŀ���dz�ȥ______ (�ѧʽ)��
(5)�ɲ���IV���õ�KI����Һ(��SO42-)�Ʊ�KI�����ʵ�鷽��:�߽��������Һ�м���������______ (�ѧʽ����ͬ),��ֽ��衢���ˡ�ϴ�Ӳ������,����Һ��ϴ��Һ�ϲ�,����HI��Һ����������,�ڲ��Ͻ������������϶��������,ֹͣ����,����������,�õ�KI���塣�ڲⶨ��Ʒ��KI����ʱ,����京��Ϊ101.5%,��ԭ������Dz�Ʒ�к���______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ����������������������(������Ϊ����)����ѡ�õ��Լ��ͷ��뷽���ܴﵽʵ��Ŀ�ĵ��ǣ�
����� | �Լ� | ���뷽�� | |
A | �����ױ��� | ��ˮ | ��Һ |
B | ���飨��ϩ�� | ���� | ���� |
C | �������������ᣩ | NaOH��Һ | ���� |
D | ���ۣ��Ȼ��ƣ� | ����ˮ | ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��X����ѧ��ѧ�г��������ʡ���һ�������£�����֮���ת����ϵ����ͼ��ʾ(���ֲ�������ȥ)��
![]()
�ش���������:
��1����X�ǿ�������Ҫ�ɷ�֮һ����A��������_____(�����)��
a.Na b.C c.S d.Al
��2����A�������������CΪ����ɫ���塣д����A����B�Ļ�ѧ����ʽ___________��
��3����C����������θ����࣬X��һ�ֳ������������塣
�ټ����Ũ�ȵ�B��Һ��C��Һ����ѡ�õ��Լ�Ϊ______________(�ѧʽ)��
�ڽ�A��B��C������Һ��ϣ���45mL���Һ����μ���һ��Ũ�ȵ����ᣬ������������(��״��)���������������ϵ����ͼ��ʾ��
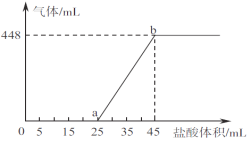
д��ab����������Ӧ�����ӷ���ʽ__________________________��b���Ӧ��Һ�����ʵ����ʵ���Ũ��Ϊ___________(��·��Һ����仯)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�����������������й㷺��Ӧ�ã��ش��������⣺
��1������ԭ�ӽṹʾ��ͼΪ �� ��λ��Ԫ�����ڱ��ĵ����ڣ����壮
��2��ʵ�����Ʊ����������ij��÷��������Ȼ�����Һ�еμӰ�ˮ����Ӧ�����ӷ���ʽΪ ��
��3�������£�����ˮ����Ӧ�������ȵ������ˮ����������Ӧ����Ӧ�Ļ�ѧ����ʽΪ ��
��4������ij��Һ���Ƿ���Fe3+�IJ��������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com