
【题目】实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
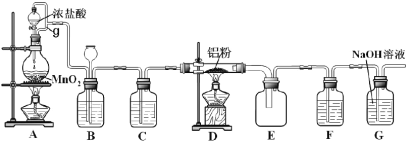
(1)A中反应的化学方程式为_________;HCl在反应中表现出的性质为______(填:酸性、氧化性或还原性)。
(2)A中g管的作用是________。
(3)B中盛放饱和食盐水的作用是________;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________。
(4)C和F所装试剂相同,其中F的作用是___________。
【答案】MnO2+4HCl![]() MnCl2+Cl2↑+2H2O 酸性、还原性 平衡气压,使盐酸顺利流出,并防止漏气 除去混有的HCl气体 长颈漏斗中液面上升或瓶中液面下降 防止G中水分扩散到E中与产品反应
MnCl2+Cl2↑+2H2O 酸性、还原性 平衡气压,使盐酸顺利流出,并防止漏气 除去混有的HCl气体 长颈漏斗中液面上升或瓶中液面下降 防止G中水分扩散到E中与产品反应
【解析】
根据所给的装置图可知,A装置制取氯气:二氧化锰和浓盐酸反应生成二氯化锰和氯气以及水,反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2 ↑+2H2O,氯化氢易挥发,制取的氯气中含有氯化氢,B中的饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,C装置进行氯气干燥,干燥后的氯气进入D装置与铝反应,2Al+3Cl2
Mn2++Cl2 ↑+2H2O,氯化氢易挥发,制取的氯气中含有氯化氢,B中的饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,C装置进行氯气干燥,干燥后的氯气进入D装置与铝反应,2Al+3Cl2![]() 2AlCl3,E收集产品,F防止空气中的水蒸气进入E装置,氯气有毒,通过G吸收.
2AlCl3,E收集产品,F防止空气中的水蒸气进入E装置,氯气有毒,通过G吸收.
(1)根据所给的装置图可知,A装置制取氯气:二氧化锰和浓盐酸反应生成二氯化锰和氯气以及水,A中反应的化学方程式为:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O;HCl在反应中一部分氯化合价不变,一部分氯化合价升高,表现出的性质为酸性、还原性。
MnCl2+Cl2↑+2H2O;HCl在反应中一部分氯化合价不变,一部分氯化合价升高,表现出的性质为酸性、还原性。
(2)A中g管的作用是平衡气压,使盐酸顺利流出,并防止漏气。
(3)A装置制取氯气,氯化氢易挥发,制取的氯气中含有氯化氢,氯气在饱和食盐水中溶解度小,B中的饱和食盐水是为了除去混有的HCl气体;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为长颈漏斗中液面上升或瓶中液面下降。
(4)C和F所装试剂相同,其中F的作用是防止G中水分扩散到E中与产品反应。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】研究性学习的本质在于,让学生亲历知识产生与形成的过程。我校某化学研究性学习小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3灼烧制成Na2CO3.
【实验设计】如图1所示

【实验探究】
(1)装置乙的作用是 .
(2)若在NaHCO3灼烧中时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 。
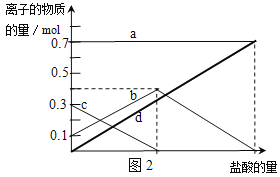
(3)若将装置甲产生的纯净的CO21.68L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为7.4g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
A. 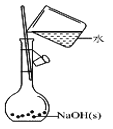 配制0.10mol/LNaOH溶液
配制0.10mol/LNaOH溶液
B. 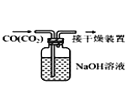 除去CO中的CO2
除去CO中的CO2
C. 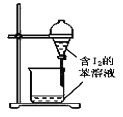 苯萃取碘水中的I2,分出水层后的操作
苯萃取碘水中的I2,分出水层后的操作
D. 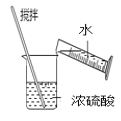 稀释浓硫酸
稀释浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
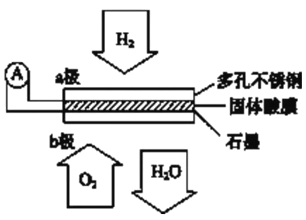
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:SiO2、Na2O、CaO、CuO、Fe2O3。现将该固体进行如下实验(所加试剂均过量):
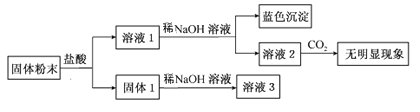
下列说法正确的是( )
A.该混合物一定含有CuO、SiO2,可能含有Na2O
B.该混合物可能含有Fe2O3
C.该混合物一定不含CaO和Na2O
D.无法确定是否含有CaO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用112 L(标准状况)氯气与足量石灰乳反应,制得的漂白粉中有效成分Ca(ClO)2的最大含量为___________mol。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。
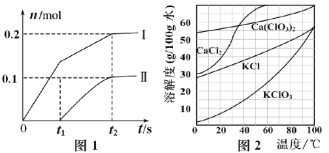
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为_____________。
②该反应过程中消耗Ca(OH)2的质量为_____________。
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是________________(不要求填具体操作步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学常用于混合物分离和提纯的装置,请根据装置回答问题:
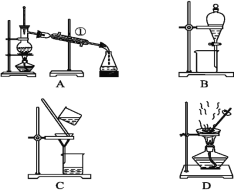
(1)从氯化钾溶液中得到氯化钾固体,选择装置____(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为__________。
(3)装置B在分液时为使液体顺利下滴,应进行的具体操作是__________________________
(4)海水中蕴藏着丰富的资源,取少量海水按如下流程进行实验:
海水![]() 粗盐
粗盐![]() 食盐水
食盐水![]() 氯化钠晶体
氯化钠晶体
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填写字母序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是

A. 化学式可以表示为KFe2(CN)6
B. 每一个立方体中平均含有24个π键
C. 普鲁士蓝不属于配位化合物
D. 每个Fe3+周围与之相邻的Fe2+离子有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
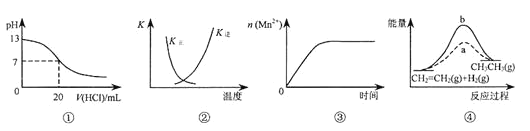
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com