
【题目】下列关于物质分类的正确组合是( )
物质分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | HNO3 | NaHCO3 | CaO | CO2 |
B | NaOH | HCl | NaCl | Fe3O4 | H2O2 |
C | Fe(OH)3 | HF | CaCO3 | CaO | SO2 |
D | NaOH | CH3COOH | CaF2 | K2O | CO |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:(N2O42NO2△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g)![]() CH3OH(g) △H=________。
CH3OH(g) △H=________。
化学键 | H-H | C-O | C | H-O | C-H |
E(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通人密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:
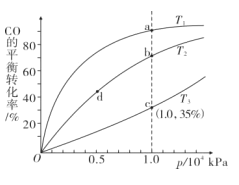
(3)比较T1、T2、T3的大小,并说明理由____。
(4)平衡常数K(b)___ K(d)、正反应速率v(a) ___v(b)(均填“大于”“小于”或“等于”)。
(5)c点时反应的压强平衡常数Kp=___ (kPa)-2(用数字表达式表示,Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是______。
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时![]() 减小
减小![]() E. CH3OH的体积分数增加
E. CH3OH的体积分数增加
(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
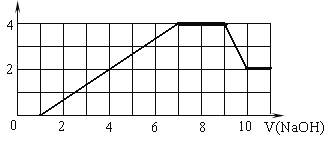
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42— 和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
A.SO2、H2S、O2
B.CO、H2、Cl2
C.NO、H2、O2
D.HCl、CO、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某课外活动小组设计的用化学电池使LED灯发光的装置。下列说法错误的是( )
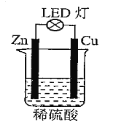
A. 正极反应为:Zn-2e-=Zn2+
B. 装置中存在”化学能→电能→光能”的转换
C. Zn为负极,Cu为正极
D. 铜表面有气泡生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;键能EO=O=499.0 kJ·mol-1则CO(g)+O2(g)CO2(g)+O(g)的ΔH=______kJ·mol-1。
Ⅱ.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。

(1)T2℃时,0~2s内的平均反应速率v(N2)= ________。
(2)该反应自发进行的条件(假设ΔH,ΔS不随温度变化而变化)___(高温自发,低温自发,任何温度均不自发,任何温度均自发)。
(3)为使该反应的反应速度增大,且平衡向正反方向移动的是________。
A.及时分离除CO2气体 B.适当升高温度
C.增大CO的浓度 D.选择高效催化剂
Ⅲ .工业可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g),在一体积可变的密闭容器中(如图),将2 mol CO和3 mol H2放入容器中,移动活塞至体积为V L,用铆钉固定在A、B点,发生反应,测得在不同条件,不同时段内CO的转化率,得出下列数据。
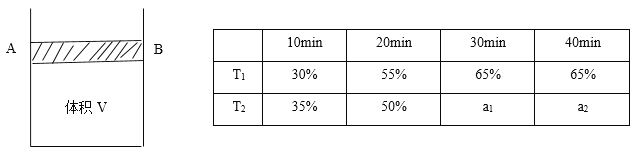
(1)根据上表数据,比较T1_______T2(选填“>、=、<”);T2温度下,第20 min时,反应达到平衡,该温度下的平衡常数为__________。
(2)T2温度下,第40 min时,拔出铆钉后,活塞没有发生移动,再向容器中通入6 mol的CO,此时V(正)________V(逆) (选填“>、=、<”),判断理由是:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com