
【题目】某元素X的气态氢化物的化学式为HX,则X的最高氧化物的水化物的化学式为( )
A.H2XO4
B.H3XO4
C.HXO3
D.HXO4
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
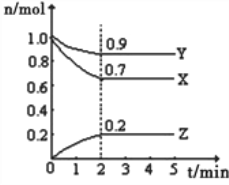
(1)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(2)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。
2HI(g)达到平衡状态的是 _________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
Ⅲ.(1)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4, 铅蓄电池放电时,_______(填物质名称)做负极。放电过程中硫酸浓度由5mol/L 下降到 4mol/L,电解液体积为 2L(反应过程溶液体积变化忽略不计),求放电过程中外电路中转移电子的物质的量为___________mol。
Pb + PbO2 + 2H2SO4, 铅蓄电池放电时,_______(填物质名称)做负极。放电过程中硫酸浓度由5mol/L 下降到 4mol/L,电解液体积为 2L(反应过程溶液体积变化忽略不计),求放电过程中外电路中转移电子的物质的量为___________mol。
(2)有人设计将两根 Pt 丝作电极插入 KOH 溶液中,然后向两极上分别通入乙醇和氧气而 构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:_____________
正极:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将3molA和3molB充入体积为 1L的密闭容器中,发生如下反应:aA(g)+2B(g)3C(g)+D(g).反应达到平衡后,C的浓度为 3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中化学键的类型完全相同的是( )
A.NaCl MgCl2 Na2O
B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4
D.NH4Cl H2O CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:
B(g)A(g)+H2(g)△H=+125kJmol﹣1
(1)该反应的平衡常数表达式为K= . 随着温度的升高,K值(填“增大”、“减小”或“不变”).
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应).物质B的平衡转化率与水蒸气的用量、体系总压强关系如图.
①由图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越;
结论二:
②加人稀释剂能影响反应物B的平衡转化率的原因是: .
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高B的平衡转化率.试解释其原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
物质分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | HNO3 | NaHCO3 | CaO | CO2 |
B | NaOH | HCl | NaCl | Fe3O4 | H2O2 |
C | Fe(OH)3 | HF | CaCO3 | CaO | SO2 |
D | NaOH | CH3COOH | CaF2 | K2O | CO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 | A | B | C | D |
物质 | CaCl2 | H2O2 | AlCl3 | NH4Cl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是

A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应现象:有白烟生成XY ZW
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com