
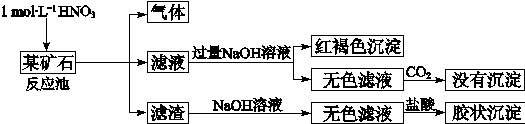
 ,所以理论上至少需要1 mol L-1 HNO3的体积为3.33×104 L。
,所以理论上至少需要1 mol L-1 HNO3的体积为3.33×104 L。

 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
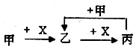
| A.①②③④均可以 | B.②③④⑤均可以 |
| C.①②③⑤ 均可以 | D.①②③④⑤均可以 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
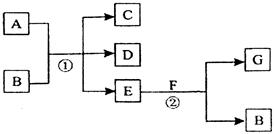
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
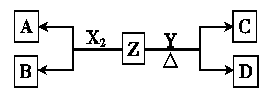
 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式 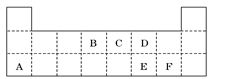
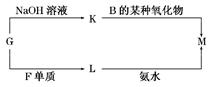
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

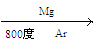 Ti
Ti查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com