
【题目】【2017吉大附中摸底】Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
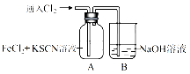
(1)B中反应的离子方程式是 ;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 ;
(3)资料显示:SCN -的电子式为![]() 。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 ;
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
请写出NaCN的电子式________,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式为 。
【答案】(12分) Ⅰ(1) Cl2+2OH﹣═Cl﹣+ClO﹣+H2O (2分) (2) Fe3+ (2分)
(3)① 硫元素(也可写-2价硫元素,或-2价S) (2分) ② 16(2分)
Ⅱ. Na+![]() (2分) CN﹣+H2O2+H2O═NH3↑+HCO3﹣ (2分)
(2分) CN﹣+H2O2+H2O═NH3↑+HCO3﹣ (2分)
【解析】Ⅰ.(1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+;
(3)①加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素;
②SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知每生成1mol二氧化碳要转移16mol电子;
Ⅱ.(1)NaCN为离子化合物,由Na+和CN-构成,所以电子式为:Na+![]() ,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的离子方程式为:CN-+H2O2+H2O═NH3↑+HCO3-;,故答案为:Na+
,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的离子方程式为:CN-+H2O2+H2O═NH3↑+HCO3-;,故答案为:Na+![]() ;CN-+H2O2+H2O═NH3↑+HCO3-。
;CN-+H2O2+H2O═NH3↑+HCO3-。


科目:高中化学 来源: 题型:
【题目】小明在实验室中配制稀NaOH溶液,将浓NaOH溶液倒入盛自来水的烧杯中时,发现溶液变浑浊,由此推测自来水中可能含有的离子是( )
A. Na+ B. Ba2+ C. Mg2+ D. Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质实验方案合理的是(括号内的物质为杂质)
A. 乙烷(乙烯),将混合气体通入酸性高锰酸钾溶液进行洗气
B. 溴苯(溴单质),加入苯萃取浪单质
C. 乙酸乙酯(乙酸),加入饱和碳酸钠溶液,然后分液
D. 乙醇(少量水),加生石灰后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015山西模拟】氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分.请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL.则通入氧气的体积可能为 .
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g).
起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
甲 | 1 | 2 | 0 | 0 |
乙 | 4 | 8 | 0 | 0 |
丙 | 0.2 | x | y | z |
①恒温恒容下,平衡时NH3的转化率甲 乙.(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x= ,y= ,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1<T2,则a1 a2.
A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200mL 1mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是 .
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、NO、HNO3.根据要求回答下列问题:
(1)写出该反应的化学方程式: .反应过程中,氧化剂和还原剂物质的量之比为 .
(2)若反应中生成0.2mol HNO3,转移的电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.地下钢管连接镁块
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.水中的钢闸门连接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
A.铜和浓硝酸反应
B.铜和稀硝酸反应
C.氧化铜和硝酸反应
D.氯化铜和硝酸银反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A. 氯气作水杀菌消毒剂
B. 硅胶作袋装食品的干燥剂
C. 二氧化硫作纸浆的漂白剂
D. 氯化铁溶液用于铜制印刷线路板制作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com