
| A、Al2O3 |
| B、KAl(SO4)2 |
| C、Al(OH)3 |
| D、Al |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
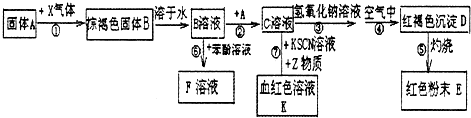
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol碳和水反应吸收131.3kJ能量 |
| B、1mol碳原子和1mol水分子反应生成1mol一氧化碳分子和1mol氢分子并吸收131.3kJ热量 |
| C、1mol固态碳原子和1mol气态水分子反应生成1mol气态一氧化碳分子和1mol气态氢分子并吸收131.3kJ热量 |
| D、1个固态碳原子和1个水蒸气分子反应吸热131.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色.
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色.| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子或分子 | 要求 |
| A | K+、OH-、淀粉、I- | 滴加氯水立即变蓝 |
| B | Fe2+、NO3-、SO42-、H+ | 通Cl2后加KSCN溶液呈血红色 |
| C | Na+、HCO3-、Ca2+、Cl- | 滴加氢氧化钠溶液立即有沉淀产生 |
| D | K+、NO3-、Cl-、HS- | c(K+)<c(HS-) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,平衡向逆反应方向移动,正反应速率减慢 |
| B、容积不变,加入1molN2(N2不参加反应),反应速率不变 |
| C、压强不变,加入1molN2(N2不参加反应),反应速率不变 |
| D、容积不变,加入1molN2,则正反应速率加快,逆反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
| A、反应在前50s的平均速率为v(NO2)=0.0012mol?L-1?s-1 |
| B、保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆) |
| C、保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的△H<0 |
| D、T温度时,若起始向容器中充入2.0molN2O4,则平衡时N2O4的转化率大于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com