
【题目】把少量过氧化钠投入下列溶液中,有白色沉淀生成的是( )
A.1mol/L氢氧化钠
B.饱和碳酸氢钠
C.1mol/L硫酸亚铁
D.饱和碳酸钠
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
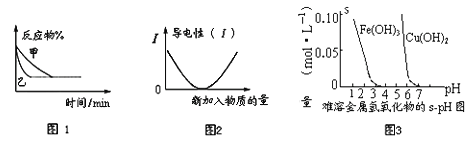
A. 图1可能表示压强对可逆反应A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B. 图2可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 据图3,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH到4左右
D. 当反应COCl2(g) ![]() CO(g) + Cl2(g) △H>0,达到平衡时①升温②减压③加催化剂都能提高COCl2转化率
CO(g) + Cl2(g) △H>0,达到平衡时①升温②减压③加催化剂都能提高COCl2转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. M﹣空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e﹣=4OH﹣
D. 比较Mg、Al、Zn三种金属﹣空气电池,Mg﹣空气电池的理论比能量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应属于同一反应类型的是( )
A.苯的硝化反应;乙烯使溴水褪色
B.葡萄糖与新制氢氧化铜共热;无水乙醇与浓硫酸共热制乙烯
C.乙醇和乙酸制乙酸乙酯;乙烷和氯气得到氯乙烷
D.乙醇和氧气制乙醛;苯和液溴制溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能发生加成反应,乙烷不能发生加成反应
C.甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色
D.苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________________________。
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_______________。
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式:①_____________________________________;
_____________________________________。
(4)D、A按原子个数比3∶2形成化合物丙的化学式为____________。
(5)C、B可按原子个数比1∶1形成化合物乙的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____种不同运动状态的电子,有_____种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______晶体,试比较组成该物质的两微粒半径大小____________________。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO![]() 3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________,
滴入少量盐酸,上述体系中Al3+浓度_______(填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________极可得金属铝的质量为__________克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com