
����Ŀ�������������ա�
��1������21.6g��CO��CO2��ɵĻ�����壬�ڱ�״���������Ϊ13.44L���û�������ƽ��Ħ������Ϊ___________,�û�������к�CO2�����ʵ���Ϊ__________mol��
��2����֪ij����������ҺVmL�к���N�����������ӣ��������������Һ�����ʵ���Ũ��_________��
��3����֪����1��ˮ����ȫ�ܽ���336���Ȼ���(��״����)�����״���´��Ȼ�����Һ�����ʵ���������Ϊ_______________��������һλС��)��
���𰸡� 36g/mol 0.3 ![]() mol/L 35.4%
mol/L 35.4%
����������1�������������ʵ�����13.44L��22.4L/mol��0.6mol�����Ըû�������ƽ��Ħ������Ϊ21.6g��0.6mol��36g/mol������������CO��xmol��CO2��ymol����x+y��0.6��28x+44y��21.6�����x��y��0.3����2�������������ʵ�����![]() ����������������
����������������![]() �����������Ƶ����ʵ���Ũ����
�����������Ƶ����ʵ���Ũ����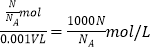 ����3���Ȼ����������
����3���Ȼ����������![]() ���ܼ�ˮ��������1000g��������ʵ�����������
���ܼ�ˮ��������1000g��������ʵ�����������![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧ��Ӧ���ʺͻ�ѧƽ��ķ����У�����ȷ����
����һ�ܱ������г���1 mol H2��1 mol I2���ﵽƽ����ֺ�ѹ���������ټ���1 mol H2��1 mol I2�����´ﵽƽ��ʱ����Ӧ��������
���Ѵ�ƽ��ķ�ӦN2(g)+3H2(g)![]() 2NH3(g) ��H<0�������¶ȣ�������������Ӧ���ʣ���С�淴Ӧ����
2NH3(g) ��H<0�������¶ȣ�������������Ӧ���ʣ���С�淴Ӧ����
����2 L�ܱ������г���2 mol A�����1 mol B���壬��һ�������·�����Ӧ��2A(g)+B(g)![]() 2C(g)���ﵽƽ��ʱ��C��Ũ��Ϊ0.6 mol/L����A��ת����Ϊ30%
2C(g)���ﵽƽ��ʱ��C��Ũ��Ϊ0.6 mol/L����A��ת����Ϊ30%
��Mg��Al����ͬ�����·ֱ���0.1 mol/L���ᷴӦ����Ӧ������ͬ
A���٢� B���٢ڢ� C���ڢۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A(g)+xB(g) ![]() 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ��
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ��
���� | �� | �� | �� |
�ݻ� | 0.5L | 0.5L | 1.0L |
�¶�/�� | T1 | T2 | T2 |
��Ӧ�� ��ʼ�� | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
����˵����ȷ����
A��10 min�ڼ������з�Ӧ��ƽ������v(A)=0.025 mol/(Lmin)
B����ͼ��֪��T1��T2���Ҹ÷�ӦΪ���ȷ�Ӧ
C��x=1����ƽ��ʱ�����¶Ȳ��䣬�ı��������ƽ���ƶ�
D��T1������ʼʱ�������г���0.5molA��1.5molB��ƽ��ʱA��ת����Ϊ75%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��X�γɵ�����������ӵĺ�������Ų���ͬ����X�����Ӱ뾶С�ڸ����������ӵİ뾶��XԪ��Ϊ�� ��
A. Al B. P C. Ar D. K
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ں���0.1mol/LSO42- ����Һ�в��ܴ����������
A.Al3+B.Cu2+C.Fe3+D.Ba2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
������״����Ͻ�TiNi�����㷺�����������Ǻ�����ɴ������ߣ����ٴ�ҽ��������Ҳ���й㷺��Ӧ�á��ش��������⣺
(1)д����̬Tiԭ�ӵĵ����Ų�ʽ:_________��Ni��Ԫ�����ڱ��е�λ����_________��
(2)�����Ͻ��������ȵ���������Ti(SO4)2��NiSO4�����������ӵ����幹��Ϊ______������ԭ�ӵĹ���ӻ�������_______��
(3)��ҵ�Ͻ����ʯ(��Ҫ�ɷ�TiO2)ת��ΪҺ̬TiCl4�����ý���þ�ڸ����»�ԭ�õ������ѣ�ͬʱ����MgCl2��
��MgCl2���۷е��TiCl4�ߵö࣬��ԭ����______��
��ԭ�Ӱ뾶r(Cl)_____r(Mg)�����Ӱ뾶r(O2-)______r(Mg2+)(���������������=��)��
(4)����������CO��Ӧ����һ�������Ni(CO)4(������Ϊ��ɫҺ��)��Ni(CO)4�Ĺ�������_____���壬Ni��CO֮��Ļ�ѧ����Ϊ__________���ṩ�¶Ե��ӵijɼ�ԭ����_________������Ԫ�ط��ţ�
(5)һ�������Ͻ�����������ṹ��ͼ��ʾ:
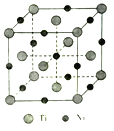
�ٸúϽ���Ti����λ��Ϊ________��
�����Ͻ���ܶ�Ϊd g/cm3�������߳�a=________pm�����ú�d�ļ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
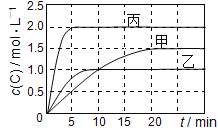
����Ŀ����֪NO2��N2O4 ���ת���� 2NO2( g)![]() N2O4(g) ��H=24.2 kJ mol1���ں����£� ��һ������N2O4�Ļ������������Ϊ2 L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������������������
N2O4(g) ��H=24.2 kJ mol1���ں����£� ��һ������N2O4�Ļ������������Ϊ2 L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������������������

A��ǰ10 min�ڣ���v(NO2)��ʾ�ķ�Ӧ����Ϊ0. 02 molL1min1
B����Ӧ���е�10 minʱ����ϵ���յ�����Ϊ9.68 kJ
C��b��d������v(��)��v(��)�����
D��25 minʱ������Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڷǽ���Ԫ�ؼס�����Ԫ�����ڱ��е����λ�����±���ʾ�������ж���ȷ����(����)
�� | �� | |
�� | �� |
A. ԭ�Ӱ뾶���ף���
B. ԭ���������������ף���
C. ԭ�Ӻ�����Ӳ�����������
D. Ԫ�ص�����������Ӧˮ��������ԣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������뵽������Һ�����ܲ��������������(����)
A. ���� B. Na2SO4��Һ
C. NaHCO3������Һ D. NaCl��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com