
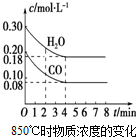
 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
分析 (1)0-4min可知,△c=0.3mol/L-0.18mol/L=0.12mol/L,结合v(H2O)=$\frac{△c}{△t}$计算;
(2)①850℃达到平衡,c(CO)=0.08mol/L,该反应为放热反应,升高温度逆向移动;
②表中3min-4min之间各物质的浓度不变;
③化学平衡常数K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$;
④由表中5min-6min之间数值可知,CO的浓度减小,而H2O的浓度增大,平衡正向移动,以此来解答;
⑤随着反应进行,反应物CO的浓度减小,CO表示的反应速率减小;
⑥根据温度、浓度、压强和催化剂对反应速率和化学平衡的影响分析.
解答 解:(1)0-4min可知,△c=0.3mol/L-0.18mol/L=0.12mol/L,则v(H2O)=$\frac{△c}{△t}$=$\frac{0.12mol/L}{4min}$0.03mol•(L•min)-1,
故答案为:0.03;
(2)①又850℃达到平衡,c(CO)=0.08mol/L,该反应为放热反应,升高温度逆向移动,所以温度t>850℃;
故答案为:>;
②表中3min-4min之间各物质的浓度不变,则达到化学平衡状态;
故答案为:平衡;
③5min时,c(CO2)=c(H2)=0.09mol•L-1,则化学平衡常数K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$=$\frac{0.090×0.090}{0.110×0.210}$=0.35;
故答案为:0.35;
④由表中5min-6min之间数值可知,CO的浓度减小,而H2O的浓度增大,平衡正向移动,则改变的条件为体积不变,通入水蒸气,
故答案为:B;
⑤随着反应进行,反应物CO的浓度减小,CO表示的反应速率减小,所以v(2~3)>v(5~6);
故答案为:v(2~3)>v(5~6);
⑥A.该反应正方向为放热反应,适当升高温度,反应逆向进行,故A错误;
B.该反应的反应前后气体的物质的量不变,缩小反应容器的体积,平衡不移动,故B错误;
C.增大CO的浓度,反应速率增大,平衡正向移动,故C正确;
D.选择高效催化剂,反应速率增大,平衡不移动,故D错误;
故答案为:C.
点评 本题考查化学平衡计算、化学平衡移动、平衡常数、浓度随时间变化曲线等,注意把握图象中曲线变化以及表格中数据的分析应用是解本题关键,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol Al与足量盐酸反应转移电子数为1NA | |
| B. | 500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA | |
| C. | 常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA | |
| D. | 标准状况下,11.2 L H2O所含的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com