
【题目】常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是________________________________。
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中含有Fe3+的操作方法:______________________________。
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁,原因是(结合化学方程式说明)___________________。
(4)向上述滤液中加入NaOH 溶液后,观察到的现象为_______________________。沉淀由白色变为红褐色的原因是______________________________________(用化学方程式表示)
(5)为了得到白色的Fe(OH)2沉淀,并尽可能可能较长时间保持白色沉淀,该同学设计了如图所示的装置,请简述实验操作:______________________________________________________。

【答案】 3Fe+4H2O(g) ![]() Fe3O4+4H2 取少量滤液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液变为红色,说明原滤液中含有Fe3+,否则不含Fe3+ 如果反应后的混合物中铁粉过量,可发生反应:Fe+2Fe3+=3Fe2+,铁粉将溶液中的Fe3+全部还原为Fe2+,加入KSCN 溶液后不会变为红色 生成白色沉淀,迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O==4Fe(OH)3 实验时,先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的H2排出装置中的空气;然后关闭K,利用生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可在盛NaOH 溶液的试剂瓶中较长时间保存白色Fe(OH)2沉淀
Fe3O4+4H2 取少量滤液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液变为红色,说明原滤液中含有Fe3+,否则不含Fe3+ 如果反应后的混合物中铁粉过量,可发生反应:Fe+2Fe3+=3Fe2+,铁粉将溶液中的Fe3+全部还原为Fe2+,加入KSCN 溶液后不会变为红色 生成白色沉淀,迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O==4Fe(OH)3 实验时,先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的H2排出装置中的空气;然后关闭K,利用生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可在盛NaOH 溶液的试剂瓶中较长时间保存白色Fe(OH)2沉淀
【解析】(1).在高温下,铁粉能与水蒸气反应生成Fe3O4和H2,反应方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(2).检验所得滤液中是否含有Fe3+,可利用Fe3+与SCN-反应使溶液显红色进行检验,具体的操作方法是:取少量滤液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液变为红色,说明原滤液中含有Fe3+,否则不含Fe3+,故答案为:取少量滤液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液变为红色,说明原滤液中含有Fe3+,否则不含Fe3+;
(3).铁与水蒸气反应生成的四氧化三铁可与稀硫酸发生反应:Fe3O4+8H+=Fe2++2Fe3++4H2O,若铁粉过量,还可以和铁离子反应生成亚铁离子:Fe+2Fe3+=3Fe2+,所以滤液中可能含有铁离子,也可能不含有铁离子,故答案为:如果反应后的混合物中铁粉过量,可发生反应:Fe+2Fe3+=3Fe2+,铁粉将溶液中的Fe3+全部还原为Fe2+,加入KSCN 溶液后不会变为红色;
(4).向上述滤液中加入NaOH 溶液后,Fe2+与OH-反应生成Fe(OH)2,Fe(OH)2不稳定,接触空气时很快被氧化为Fe(OH)3,现象是生成白色沉淀,迅速变为灰绿色,最终变为红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3,故答案是:生成白色沉淀,迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;
(5).要较长时间观察到氢氧化亚铁的白色沉淀,关键是尽量减少氢氧化亚铁与空气接触,可以利用生成的氢气赶走装置中的空气,实验步骤为:实验时,先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的H2排出装置中的空气;然后关闭K,利用生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可在盛NaOH 溶液的试剂瓶中较长时间保存白色Fe(OH)2沉淀,故答案为:实验时,先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的H2排出装置中的空气;然后关闭K,利用生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可在盛NaOH 溶液的试剂瓶中较长时间保存白色Fe(OH)2沉淀。


科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
(1)Z2+基态核外电子排布式为 .
(2)YX4﹣的空间构型是;与YX4﹣互为等电子体的一种分子为(填化学式);HYX4酸性比HYX2强,其原因是 .
(3)结构简式为RX(W2H3)2的化合物中R原子的杂化轨道类型为;1molRX(W2H3)2分子中含有σ键数目为 .
(4)往Z的硫酸盐溶液中通入过量的WH3 , 可生成[Z(WH3)4]SO4 , 下列说法正确的是 .
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子). 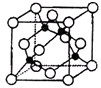
①该晶体的化学式为 .
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于(填“离子”、“共价”)化合物.
③已知该晶体的密度为ρg.cm﹣3 , 阿伏伽德罗常数为NA , 则该晶体中Z原子和Y原子之间的最短距离为pm(只写计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 烧碱、纯碱、熟石灰均属于碱,稀豆浆、FeCl3溶液、蛋白质溶液均属于胶体
B. SO2、NO2、CO2等非金属氧化物都是酸性氧化物
C. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D. 葡萄糖溶液和淀粉溶液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgCl、AgBr及AgI的Ksp依次为1.6×10﹣10、4.8×10﹣13和1.6×10﹣16 , 现将物质的量均为1.5×10﹣2mol的NaI,NaBr、NaCl和4.0×10﹣2mo1AgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
A.只生成AgBr及AgI两种沉淀
B.溶液中c(I﹣)≈1.0×10﹣9mol/L
C.溶液中c(Br﹣)≈3.0×10﹣5mol/L
D.溶液中c(Ag+)≈3.2×10﹣8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( ) 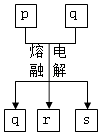
A.原子半径:Y>Z>W>X
B.q属于离子化合物
C.p能与盐酸反应,但不能与氢氧化钠溶液反应
D.一定条件下,r与s能发生化合反应生成p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为____________,反应类型是____________。
(3)已知: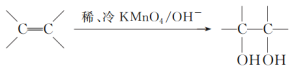 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如图. 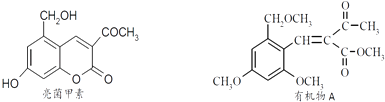
(1)“亮菌甲素”的分子式为: , 1mol“亮菌甲素”跟溴水反应时最多消耗mol Br2;能发生水解反应的官能团名称是 , 能发生还原反应的官能团名称是
(2)有机物A能发生如下转化,其中G分子中的碳原子在一条直线上. 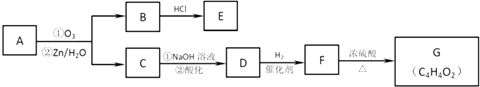
信息提示:i. ![]()
ii.R﹣O﹣CH3 ![]() R﹣OH(R为脂肪烃或芳香烃基)
R﹣OH(R为脂肪烃或芳香烃基)
①B→E的化学方程式是: .
②G的结构简式是: .
③H是G的一种同分异构体,可以发生水解反应,写出其结构简式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com