
【题目】CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
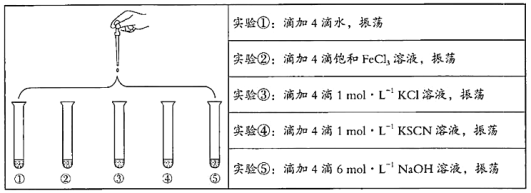
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+![]() O2(g)═H2O(g) △H=﹣242kJmol﹣1
O2(g)═H2O(g) △H=﹣242kJmol﹣1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a.  b.
b. 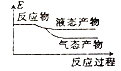 c.
c. 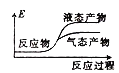 d.
d. 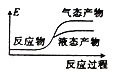
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣90.1kJmol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(molL﹣1)变化如下表所示(前6min没有改变条件)
2min | 4min | 6min | 8min | ||
CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
H2 | x | 0.12 | 0.12 | 0.2 | …… |
CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000molL﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)用系统命名法命名![]() ___;
___;
(2)相对分子质量为114,其一氯代物只有一种的链烃的结构简式___;
(3)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为__。
Ⅱ.(1)将有机物B置于氧气流中充分燃烧,实验测得生成7.2gH2O和13.2gCO2,消耗氧气10.08L(标准状况),则该物质中各元素的原子个数之比是___。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为___,该物质的分子式是___。

(3)根据价键理论,预测A可能的结构简式:___(写出其中2种)。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值可以确定分子中氢原子的种类和数目。经测定,有机物A的核磁共振氢谱如图②,则A的结构简式为:____。
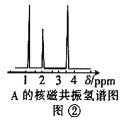
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列有关叙述正确的是( )
①1mol苯中含有的碳碳双键数为3NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N﹣H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
A. ①④⑤⑦ B. ②⑤⑧ C. ②④⑤⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
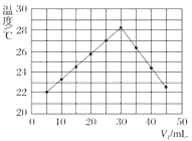
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种过渡元素,金属铁是最常用的金属材料。请回答下列有关问题:
(1)工业上常利用CO还原铁的氧化物冶炼铁。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19kJ/mol
请写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_____。
(2)11.2gFe与一定量的HNO3充分反应后,Fe全部溶解,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水槽中,气体恰好被完全吸收,O2的物质的量是____。
(3)利用电解实验可以制得纯净的Fe(OH)2,装置如图所示,两电极分别是石墨和铁,电解质溶液为NaCl溶液。
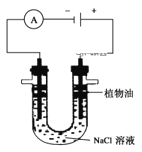
①植物油的作用是___,在加入植物油之前,要对NaCl溶液作何处理:____。
②阳极的电极反应式为____。
③若将该装置改为防止Fe发生电化学腐蚀的装置,则Fe电极应与电源____极相连,当电路中通过2mol电子时,两极共收集到气体___L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=__。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__,溶液中离子浓度大小关系为__。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)=__。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__。(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是

A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com