
����Ŀ��ʵ��С���Ʊ��������(K2FeO4)��̽�������ʡ�
���ϣ�K2FeO4Ϊ��ɫ���壬����KOH��Һ������ǿ�����ԣ������Ի�������Һ�п��ٲ���O2���ڼ�����Һ�н��ȶ���
�� �Ʊ�K2FeO4(�г�װ����)
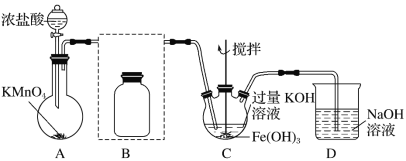
��1��A������_____________
��2���ڴ���ֽ�Ͻ�����װ��B�������������������Լ���________
��3����C�еõ���ɫ����Ļ�ѧ����ʽΪ��______________
��̽��K2FeO4�����ʣ�ȡC����ɫ��Һ������ϡ���ᣬ�����������Һa��Ϊ֤���Ƿ�K2FeO4������Cl��������Cl2��������·�����
������ | ȡ����a���μ�KSCN��Һ����������Һ�ʺ�ɫ |
������ | ��KOH��Һ���ϴ��C�����ù��壬����KOH��Һ��K2FeO4�ܽ⣬�õ���ɫ��Һb��ȡ����b���μ����ᣬ��Cl2���� |
��4���ɷ���������Һ����֪a�к���_____���ӣ��������ӵIJ��������ж�һ����K2FeO4��Cl����������������_______����(�����ӷ���ʽ��ʾ)��
��5�����ݷ�����ó���������Cl2________FeO42- (����>������<��)����K2FeO4���Ʊ�ʵ��ʵ�������Cl2��FeO42-��������ǿ����ϵ�෴��ԭ����______��
���𰸡���������װ��  3Cl2��2Fe(OH)3��10KOH===2K2FeO4��6KCl��8H2O Fe3�� 4FeO42-��20H��==4Fe3����3O2����10H2O < ��Һ����Բ�ͬ
3Cl2��2Fe(OH)3��10KOH===2K2FeO4��6KCl��8H2O Fe3�� 4FeO42-��20H��==4Fe3����3O2����10H2O < ��Һ����Բ�ͬ
��������
��1��Ũ�����KMnO4��Ͽ�����������
��2��װ��BΪ����װ�ã���Ӧʹ��Ũ���ᣬŨ�����ӷ�����HCl��ʹ�ò�����Cl2�л���HCl����Ҫ��ȥHCl���ɽ��������ͨ������ʳ��ˮ�ﵽ���ӵ�Ŀ�ģ�
��3��C�еõ���ɫ�������Һ����ɫ��ΪK2FeO4���ڼ��������£�Cl2��������Fe��OH��3��ȡK2FeO4������غ㷨д��������Ӧ�Ļ�ѧ����ʽ��
��4������I�м���KSCN��Һ����������Һ�ʺ�ɫ��˵����Ӧ����Fe3+���������ӵIJ��������ж�һ��K2FeO4��Cl-������ע��K2FeO4�ڼ�����Һ���ȶ���������Һ�п��ٲ���O2������ת��ΪFe3+��
��5��Fe��OH��3�ڼ��������±�Cl2����ΪFeO42-������˵��Cl2�������Դ���FeO42-����������ʵ�������Cl2��FeO42-��������ǿ����ϵ�෴����������FeO42-����������������Cl-����Cl2��ע�����ַ�Ӧ��ϵ��������Խ��ʲ�һ����
��1��Ũ�����KMnO4��Ͽ�������������Aװ�õ���������������װ�ã�
��2��װ��BΪ����װ�ã���Ӧʹ��Ũ���ᣬŨ�����ӷ�����HCl��ʹ�ò�����Cl2�л���HCl����Ҫ��ȥHCl���ɽ��������ͨ������ʳ��ˮ�ﵽ���ӵ�Ŀ�ģ�����װ��BӦΪ ��
��
��3��C�еõ���ɫ�������Һ����ɫ��ΪK2FeO4���ڼ��������£�Cl2��������Fe��OH��3��ȡK2FeO4��������Ӧ�Ļ�ѧ����ʽΪ3Cl2��2Fe(OH)3��10KOH===2K2FeO4��6KCl��8H2O��
��4������I�м���KSCN��Һ����������Һ�ʺ�ɫ��˵����Ӧ����Fe3+���������ӵIJ��������ж�һ��K2FeO4��Cl-������ע��K2FeO4�ڼ�����Һ���ȶ���������Һ�п��ٲ���O2������ת��ΪFe3+��������ӦΪ��4FeO42-+20H+�T4Fe3++3O2��+10H2O��
��5��Fe��OH��3�ڼ��������±�Cl2����ΪFeO42-������˵��Cl2�������Դ���FeO42-����������ʵ�������Cl2��FeO42-��������ǿ����ϵ�෴����������FeO42-����������������Cl-����Cl2�����ַ�Ӧ��ϵ��������Խ��ʲ�һ�������Կ���˵����Һ����Ի�Ӱ�����������Ե�ǿ����


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУͬѧ�������ʵ�飬̽��CaS�ѳ������е�SO2������S��ʵ�鲽�����£�
����1.��ȡһ������CaS����������ƿ�в�����״����ܼ�(����ͼ��ʾ)��
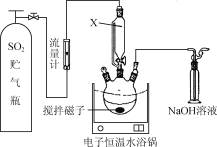
����2.��CaS�ļ״�����Һ�л���ͨ��һ������SO2��
����3.���ˣ�����Һ��������
����4.����Һ�л��ռ״�(�е�Ϊ64.7 ��)�����ò����벽��3�������ϲ���
����5.��CS2����������ȡ���յ���S��
(1) ͼ��������X������ͨ��Һ©����ͻ���ŵ���________________��
(2) ������ƿ���������������ƵĻ�ѧ����ʽΪ________________��������ƿ�������������к�һ������CaSO4����ԭ����________________��
(3) ����4�����ռ״�������еIJ���������________________��
(4) ����5Ϊʹ������S�����ܱ���ȡ���ɲ�ȡ�IJ���������________________��
(5) ����ƴ��������յ�S�͵õ��ĺ�Na2SO3����Һ�Ʊ�Na2S2O3��5H2O��ʵ�鷽����
��ȡ�Թ�����۷����ձ��У�__________________________________________������ֽ���ɡ�
��֪���� ��Һ�����״̬�£��ɷ�����ӦNa2SO3��S��5H2O![]() Na2S2O3��5H2O��
Na2S2O3��5H2O��
��������Na2SO3��Һ�������Ҵ���
��Ϊ��ô�����Ʒ����Ҫ������ɫ������
����ʹ�õ��Լ���S��Na2SO3����Һ���Ҵ�������̿��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��صķ����ǻ�ѧ�������һ���ش��ס�
��1��һ������ȼ�ϵ�أ����Զ�ײ���Ϊ�����缫����ϡ�����У�Ȼ��ֱ�������ͨ����������������õ��ܡ�ͨ�������ĵ缫��ӦʽΪ_________________��
��2�����ӹ�ҵ�ϳ�����FeCl3��Һ��ʴͭ������ӡˢ��·�������÷�Ӧԭ����Ƴ�ԭ��أ���д��ԭ��ص�������Ӧ______________________________��
��3�������£�����ȥ��������Ĥ����Ƭ��ͭƬ����ŨHNO3�����ԭ���װ����ͼ����ʾ�����ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ����ʾ����Ӧ�������к���ɫ���������

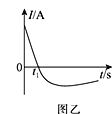
t1sǰ��ԭ��صĸ�������Ƭ�������ĵ缫��ӦʽΪ________����Һ�е�H����______����������������ƶ���t1s�����·�е��������������ı䣬��ԭ����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ��������ʵ�飬�������ǣ� ����

A. ͼ�٣���֤H2CO3����ǿ��H2SiO3 B. ͼ�ڣ��ռ�CO2��NH3
C. ͼ�ۣ�����Na2CO3��Һ��CH3COOC2H5 D. ͼ�ܣ�����C2H5OH��CH3COOC2H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���ͬpH������ʹ���ֱ��ˮϡ����ƽ�⣬pH����Һ����仯����������ͼ�� ʾ����ͼ�ж���ȷ����

A. ��Ϊ����ϡ��ʱ��pH�仯����
B. b����Һ�ĵ����Ա�c����Һ�ĵ�����ǿ
C. a��KW����ֵ��c��KW����ֵ��
D. b�������Ũ�ȴ���a�������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʥ·��˹��ѧ���Ƶ������Ҵ�ȼ�ϵ��, ���ܴ���������H+���Ľ������ܼ�, ��ӦΪC2H5OH��3O2��2CO2��3H2O����ͼ�Ǹõ�ص�ʾ��ͼ������˵����ȷ������ ��

A��a��Ϊ��ص�����
B����������ĵ缫��ӦΪ��4H+ �� O2 �� 4e��=== 2H2O
C����ع���ʱ������a���ص��߾������ٵ�b��
D����ع���ʱ��1mol�Ҵ�������ʱ����6 mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȣ�SO2C12)���л��ϳ������õ��Ȼ������ǻ������Ȼǻ������۵�-54.1�棬�е�69.1�棬�ڳ�ʪ�����л�������������������ֽ⡣ij��ѧС������ͼ��ʾװ����ȡ�����ȣ���Ӧԭ���ǣ�SO2(g)+C12(g)=SO2C12 (1)��H=-97.3kJ/mol����ش�������⡣

��1��������װ���Ժ�����Ҫ���еIJ�����____��
��2��װ��E������������___����װҩƷ��____��
��3����ȱ��װ��B��������ƿ�лᷢ������Ҫ����Ӧ��ѧ����ʽ��____(��дһ������װ��B����Ϊijװ�ú����ͬ�������ã���װ�ÿ�����____��
��4��ͨ�����������Ʋ��ͨ��Cl2������ۺϳɱ�״��Ϊ3.36L(SO2����)�����յõ���SO2C12����Ϊ8.1g�������___�����д�ʩ�����SO2C12���ʵ���___��(��ѡ����ţ�
a.�ӿ�ͨ������������
b.������ƿ�¶ȹ���ʱ�ʵ���ȴ
c.�ȴ�Һ©��������ͨ��������ͨ������ˮ
��5��ijͬѧ��ʵ������в�С�Ľ�SO2C12��H2SO4�����һ�𣬷���û����ķ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о���������ȴ�����Ⱦ��Խ����������磬�����˾ӻ���������Ҫ���塣NO�ڿ����д������·�Ӧ��2NO(g)+ O2(g)![]() 2NO2(g)��H������Ӧ��������ɣ�������ͼ��ʾ��
2NO2(g)��H������Ӧ��������ɣ�������ͼ��ʾ��
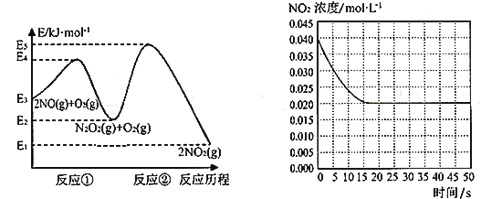
(1)д����Ӧ�ٵ��Ȼ�ѧ����ʽ(��H�ú�������E�ĵ�ʽ��ʾ)��________��
(2)��Ӧ�ٺͷ�Ӧ���У�һ���ǿ췴Ӧ������ٽ���ƽ��״̬������һ��������Ӧ������2NO(g)+O2(g)![]() 2NO2(g)��Ӧ���ʵ���____(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������____(��Ӧδʹ�ô���)��
2NO2(g)��Ӧ���ʵ���____(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������____(��Ӧδʹ�ô���)��
(3)ij�¶���һ�ܱ������г���һ������NO2�����NO2Ũ����ʱ��仯����������ͼ��ʾ��ǰ5����O2��ƽ����������Ϊ_______�����¶��·�Ӧ2NO+O2![]() 2NO2�Ļ�ѧƽ�ⳣ��KΪ_____��
2NO2�Ļ�ѧƽ�ⳣ��KΪ_____��
(4)����(3)�еķ�Ӧ��ϵ��ƽ���(ѹǿΪP1)���������¶ȣ��ٴδ�ƽ���������ƽ����Է�������_____(����������������С������������)�����ں��º��������£������г���һ����O2���ٴδ�ƽ����ѹǿΪP2��c(O2)=0.09mol��L-1����P1�UP2=___________��
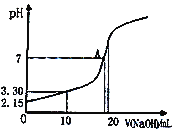
(5)ˮ�ܲ�������NO��NO2�������õ�HNO2��Һ������20.00mL0.10mol��L-1HNO2��Һ����μ���0.10mol��L-1NaOH��Һ������pH������ͼ��ʾ����A���Ӧ����Һc(Na+)/c(HNO2)=____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com