
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是

A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
【答案】B
【解析】
醋酸是弱酸,不完全电离使溶液显酸性,溶液浓度越低,电离程度越大;盐酸是强酸,在水溶液中完全电离,加等量的水稀释,盐酸溶液的pH变化大于醋酸溶液的pH变化,因此Ⅰ为盐酸的pH变化曲线,Ⅱ为醋酸的pH变化曲线。
A项,由分析可知,Ⅰ为盐酸的pH变化曲线,Ⅱ为醋酸的pH变化曲线,故A项错误;
B项,b、c两点在盐酸的pH变化曲线上,c点pH较大,稀释倍数较高,溶液中离子浓度低于b点溶液中离子浓度,离子浓度越大,导电性越强,故B项正确;
C项,KW只和温度有关,温度不变,KW不变,故C项错误;
D项,相同体积和pH的盐酸与醋酸溶液,醋酸溶液浓度大,稀释相同倍数之后,由于醋酸是弱酸,因此浓度依旧大于盐酸溶液的浓度,因此a点酸的总浓度大于b点酸的总浓度,故D项错误。
综上所述,本题正确答案为B。


科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.1H2、2H2、3H2互称同位素
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.同一周期(第一周期除外)的元素,从左到右由金属逐渐过渡到非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ 制备K2FeO4(夹持装置略)
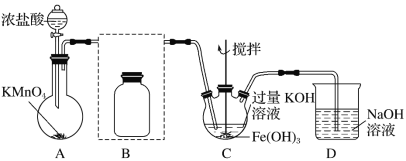
(1)A的作用_____________
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:________
(3)在C中得到紫色固体的化学方程式为:______________
Ⅱ探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
(4)由方案Ⅰ中溶液变红可知a中含有_____离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_______产生(用离子方程式表示)。
(5)根据方案Ⅱ得出:氧化性Cl2________FeO42- (填“>”或“<”),而K2FeO4的制备实验实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______________________________;滤渣可循环利用,滤渣的主要成分是____________(填化学式)。
(2)该工艺需控制NO和NO2物质的量之比接近1∶1。
若排放的尾气中NO含量升高,则NO和NO2物质的量之比______;若产品Ca(NO2)2中Ca(NO3)3含量升高,则NO和NO2物质的量之比_______。(填写序号)
①=1∶1 ②>1∶1 ③<1∶1 ④无法判断
(3)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,某同学所写的反应离子方程式为2NO2-+2H+=NO2+NO↑+H2O,你同意吗?_________(填“同意”或“不同意“),如不同意,请说明你的理由________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时用0.10mol/L的KOH溶液滴定20.00mL0.10 mol/L的H2C2O4溶液,滴定过程中溶液的pH随KOH溶液体积变化如图所示(忽略滴定过程中溶液的温度变化和体积变化),下列说法错误的是( )
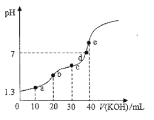
A. 25℃时H2C2O4的电离常数Ka1=10-1.6
B. b点满足关系:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
C. c点溶液中粒子浓度大小顺序:c(K+)>c(C2O42-)>c(HC2O4)>c(H2C2O4)
D. 从a点到e点水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A. d点所示溶液中:c(NH4+)═2c(SO42)
B. C点所示溶液中:c(H+)c(OH)═2c(NH3·H2O)
C. NH3·H2O的电离常数K=104
D. V=40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com