
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molNH4+含有的电子数为11NA
B.0.1L3mol/L的NH4NO3溶液中氮原子数等于0.6NA
C.常温下,92gNO2与N2O4混合气体中氧原子数为2NA
D.硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如图实验方案和实验装置。(已知SO2能与酸性KMnO4反应生成硫酸盐)

I.探究该合金的某些性质:
(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓H2SO4,A、B中均无明显现象,原因是__;
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出此时合金中成分碳参与的化学反应方程式__;
(3)装置D的作用是__;装置E的作用是__。
II.测定样品中碳的质量分数:
(4)装置F的作用__;
(5)若反应前后E装置的质量分别是m1和m2,则合金中碳的质量分数是__,若没有连接D装置会使测定结果__(填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
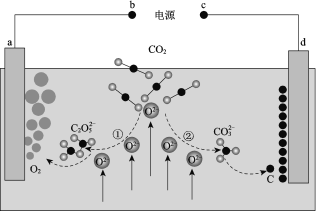
下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

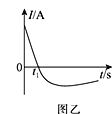
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A.CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl
CH2=CHCH2Cl+HCl
B. +Br2→
+Br2→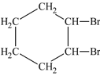
C.![]() +H2
+H2![]()
![]()
D.2CH2=CH2+O2![]() 2CH3CHO
2CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是

A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
(1)根据上述数据,可计算出该盐酸的浓度约为_______________(保留四位有效数字)。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(3)氧化还原滴定实验同中和滴定类似,指的是用已知浓度的氧化剂(还原剂)溶液滴定未知浓度的还原剂(氧化剂)溶液。现有0.001 mol·L-1KMnO4酸性溶液和未知浓度的无色H2C2O4溶液。反应离子方程式是_________________________________,滴定达到终点的标志是___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com