
为测定氯水的物质的量浓度,在100 mL氯水中加入足量的碘化钾溶液,把游离出来的碘单质按下述反应进行定量分析,耗去300 mL、1 mol/L的硫代硫酸钠(Na2S2O3)溶液I2+2Na2S2O3=NaI+Na2S4O6.问1 L氯水中溶解了多少氯气?
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
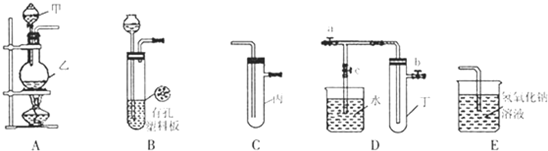
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 将氯水滴入品红溶液 | 溶液褪色 | 氯水有漂泊作用 |
| ② | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
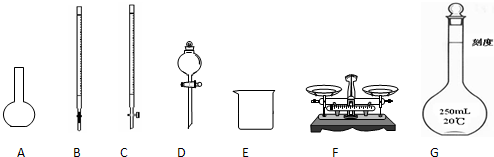
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com