

分析 粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,为防止水解,应加入过量的稀盐酸进行溶解,并保证金属完全反应,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,加入试剂X目的是将溶液中Fe2+氧化为Fe3+,应为H2O2,还原得到水,是绿色氧化剂,通过调节pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且加入Y可以消耗氢离子且不能引入新杂质,可以为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3.滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2•2H2O,
(1)Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色;能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀;
(2)调节pH至4~5之间,液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀,过滤分离;
(3)配制实验所需480mL10mol/L浓HCl时用到的玻璃仪器有:量筒、玻璃棒、烧杯、500mL容量瓶;
(4)CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干;
(5)氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒计算CuCl2•xH2O的物质的量,再结合m=nM计算x的值.
解答 解:粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,为防止水解,应加入过量的稀盐酸进行溶解,并保证金属完全反应,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,加入试剂X目的是将溶液中Fe2+氧化为Fe3+,应为H2O2,还原得到水,是绿色氧化剂,通过调节pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且加入Y可以消耗氢离子且不能引入新杂质,可以为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3.滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2•2H2O.
(1)①Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色,用高锰酸钾溶液可以检验Fe2+,故正确;
②Fe2+能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀,故正确;
③铁离子、铜离子均与NaOH反应生成沉淀,影响亚铁离子检验,故错误;
④铁离子与KSCN反应,溶液呈红色,不能检验Fe2+,故错误;
故选:①②;
(2)由上述分析可知,试剂X为盐酸,加入过量的盐酸,充分反应,抑制Cu2+水解;加入Y可以消耗氢离子调节溶液pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且不能引入新杂质,
a.NaOH引入杂质钠离子,故a错误;
b.NH3•H2O 引入铵根离子,故b错误;
c.CuO可以调节PH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3 过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节PH值,引入硫酸根离子,故e错误;
调节pH至4~5之间,使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀,
故答案为:cd;使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀;
(3)配制实验所需480mL10mol/L浓HCl时用到的玻璃仪器有:量筒、玻璃棒、烧杯、胶头滴管、500mL容量瓶,
故答案为:胶头滴管、500mL容量瓶;
(4)CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,
故答案为:D;
(5)氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒:n(CuCl2•xH2O)=n(CuO)=$\frac{n}{80}$mol,则$\frac{n}{80}$mol×(135+18x)=mg,解得x=$\frac{80m-135n}{18n}$,
故答案为:$\frac{80m-135n}{18n}$.
点评 本题考查化学工艺流程及实验制备,涉及对实验装置与操作及试剂的分析评价、物质分离提纯、化学平衡移动、化学计算等,要求学生具备扎实的基础与综合运用能力,难度很大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提取溴可用植物油作萃取剂 | |
| B. | 用热的纯碱溶液去油污效果更好 | |
| C. | 硬水使肥皂去污能力减弱是因为发生了沉淀反应 | |
| D. | 用热的碱溶液可区别植物油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的系统命名2-甲基-3-乙基己烷
的系统命名2-甲基-3-乙基己烷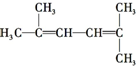
 的键线式:
的键线式:
 中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的电子数为10NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为NA | |
| D. | 1 mol/L NaCl溶液中所含的Na+为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
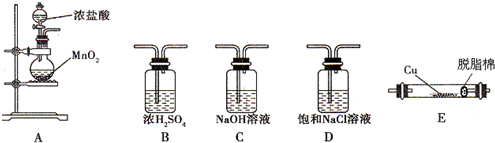
 ;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.
;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Al(SO4)2 | B. | NH4Cl | C. | NH3•H2O | D. | CH3COONH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的转化率是60% | B. | 该反应的平衡常数 是12.5 | ||
| C. | 平衡时总物质的量是2.6mol | D. | 平衡时气体的密度是15.6g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com