
| A. | NH4Al(SO4)2 | B. | NH4Cl | C. | NH3•H2O | D. | CH3COONH4 |
分析 根据铵根离子的浓度和水解的影响角度来分析,如果含有对铵根离子水解起促进作用的离子,则铵根离子水解程度增大,如果含有抑制铵根离子水解的离子,则铵根的水解程度减弱,据此进行判断.
解答 解:物质的量浓度相同的下列溶液中不考虑(水解)其他因素影响,ABD选项中铵根离子浓度分别比为1:1:1,C中NH3•H2O部分电离,铵根离子浓度最小,
A.NH4Al(SO4)2中的铝离子的水解对铵根的水解起抑制作用,导致铵根离子水解程度减小,铵根离子浓度较大;
B.氯化铵中,铵根离子的水解不受氯离子的影响;
C.NH3•H2O是弱电解质,部分电离,其铵根离子浓度最小;
D.醋酸根离子对铵根离子的水解起到促进作用,导致铵根离子水解程度大,溶液中铵根离子浓度较小;
根据分析可知,NH4+的浓度相同时,溶质的浓度最大的是NH3•H2O,
故选C.
点评 本题考查盐的水解原理及其影响、弱电解质的电离,题目难度中等,明确盐的水解原理及其影响因素为解答关键,试题培养了学生的分析能力及灵活应用能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2与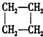 | B. |  与 与 | ||
| C. | 甲苯和二甲苯 | D. | CH2═CH-CH═CH2和CH-CH2-CH2-C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L氯气与水充分反应转移电子数为0.1NA | |
| B. | 标况下,2.24LNO2分子总数小于0.1NA | |
| C. | 标准状况下2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com