
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 1 mol羟基中所含电子的数目为7NA
B. 28 g乙烯所含共用电子对的数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含的分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下溶质浓度均为1×10﹣3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)一水合氨的电离方程式为_______,硫酸铵在水溶液中水解的离子方程式为_______。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________________________。
(3)在某温度下(Kw=1×10﹣12),将100 mL的①与100 mL的⑥溶液混合后(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的pH=_________。
(4)若将等体积的②、③溶液加热至相同温度后,溶液的pH ②_______③(填“>” 、“=”或“<”)。
(5)若将③溶液和⑥溶液按体积比2:1混合后溶液呈酸性,则混合后溶液中c(CH3COO-)_______ c(CH3COOH)(填“>” 、“=”或“<”)
(6)室温时,若用①滴定⑤,适宜的指示剂为_____,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构简式如图,下列说法不正确的是

A. X分子式为C10H20O,它是环己醇的同系物
B. X的一氯取代物有6种
C. X能使酸性高锰酸钾溶液褪色
D. 在一定条件下,X能发生消去反应生成2种烯烃(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
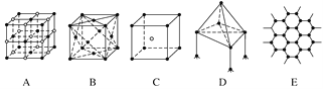
(1)其中代表金刚石的是(填编号字母,下同)____,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(3)代表干冰的是________,它属于________晶体,每个CO2分子与______个CO2分子紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B均为钾盐的水溶液,A呈中性,B有氧化性,E的溶质中有一种含+5价元素的含氧酸盐M。现有下图所示转化:
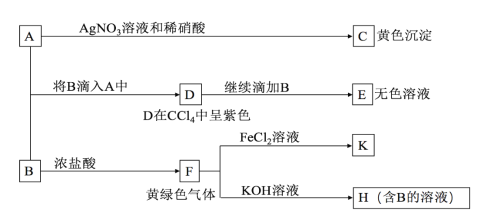
请回答:
(1)C的化学式为_________,检验气体F常用的试纸是______________
(2)写出物质M在生活中的常见用途______________
(3)写出F→H的化学方程式:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Cl、Cr、Ni等及其相关化合物用途非常广泛。回答下列问题:
(1)基态铬原子的价电子排布式为______。
(2)与硅原子未成对电子数相同的第四周期元素共有______种;钠与铝处于同周期,铝的熔沸点及硬度均比钠大,其原因是______。
(3)KAlO2在水溶液中实际上都是以K[Al(OH)4]形式存在。其中[Al(OH)4]-配离子,中心原子的杂化类型是____。该K[Al(OH)4]物质中存在的化学键有配位健、_____(填字母代号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.氢键
(4)CN2称为氰气,其性质与卤素单质相似。与氢氧化钠溶液反应产物之一为NaCN,写出两种与CN-互为等电子体的分子_____,N元素及与其同周期相邻的两种元素第一电离能由大到小的顺序为______。(填元素符号)
(5)氯化铯熔点:645℃,沸点:1290℃;氯化铝熔点:190℃,在180℃时开始升华,造成二者熔、沸点相差较大的原因是______;下图为氯化铯晶胞,已知氯离子半径为anm,铯离子半径为bnm,则氯化铯晶体密度为_____g·cm-3(用a、b和阿伏加德罗常数NA的代数式表式,列出算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构。其晶体模型如下图所示。请认真观察该晶体模型后回答以下问题:

二氧化硅的晶胞结构
(1)二氧化硅晶体中最小环为________元环。
(2)每个硅原子为________个最小环共有。
(3)每个最小环平均拥有________个硅原子、________个氧原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的_____。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用。。。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)_____。其中②中的操作中。。。处填“改用________。”
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会影响所配溶液的浓度(填“偏高”、“偏低”或“无影响”)
①用天平(不使用游码)称量时,被称量物与砝码的位置放颠倒了____
②用量筒量取液体溶质,读数时俯视量筒,所配溶液的浓度____
③用胶头滴管定容时,仰视刻度线,所配溶液的浓度____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com