
| �������� | ��ʼ���� | ������ȫ |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
| kw |
| c(H+) |
| 1��10-14 |
| 10-3 |
| 1��10-14 |
| 10-3 |
| 2.64��10-39 |
| (10-11)3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | ʵ������ | ʵ��Ŀ�� |
| A | �����£���pH��ֽ�ֱ�ⶨŨ��Ϊ0.1mol?L-1 NaClO��Һ��0.1mol?L-1 CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
| B | ���з�̪��Na2CO3��Һ�м�������BaCl2���壬��Һ��ɫ��dz | ֤��Na2CO3��Һ�д���ˮ��ƽ�� |
| C | ��10mL 0.2mol/L NaOH��Һ�е���2��0.1mol/L MgCl2��Һ��������ɫ�������ٵμ�2��0.1mol/L FeCl3��Һ�������ɺ��ɫ���� | ֤������ͬ�¶��µ�Ksp�� Mg��OH��2��Fe��OH��3 |
| D | �ֱ�ⶨ�����µ����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH�����߽ϴ� | ֤���ǽ�����S��C |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
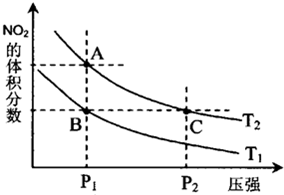
 �������������������֣���ͼ�����е�һ�ַ�����������ȷ���ǣ�������
�������������������֣���ͼ�����е�һ�ַ�����������ȷ���ǣ�������| A����ͼ��ʾ���������������������� |
| B����բ����������������ԭ��Ӧ |
| C����������a����բ�ţ������缫��b |
| D�������缫�ϵķ�Ӧ��O2+2H2O+4e=4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� ��25�棩 |
Ka=1.77��10-4 | Ka=4.9��10-10 | Ka1=4.3��10-7 Ka2=5.6��10-11 |
| A��2CN-+H2O+CO2�T2HCN+CO32- |
| B���к͵��������pH��HCOOH��HCN����NaOH����ǰ��С�ں��� |
| C�����ʵ���Ũ����ȵ�HCOONa��KCN��Һ�У�c��Na+��-c��HCOO-����c��K+��-c��CN-�� |
| D��c��NH4+����ȵ�HCOONH4��Һ��NH4CN��Һ��NH4HCO3��Һ�У�c��NH4HCO3����c��NH4CN����c��HCOONH4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������ѧ֪ʶ������������⣺
��������ѧ֪ʶ������������⣺| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| n(H2) |
| n(CO2) |
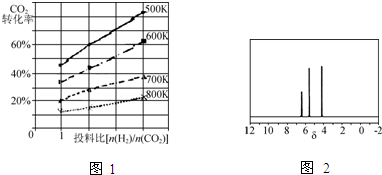
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʳ�׳�ȥˮ���ڵ�ˮ����CaCO3+2H+�TCa2++CO2��+H2O |
| B����FeCl3��Һ��ʴͭ��·�壺Cu+Fe3+�TCu2++Fe2+ |
| C��FeBr2��Һ��ͨ������Cl2��2Br-+Cl2�TBr2+2Cl- |
| D����NaHCO3��Һ�м�������ʯ��ˮ��2HCO3-+2OH-+Ca2+�TCaCO3��+CO32-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��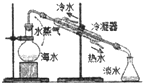 ��ˮ���� |
B��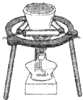 ���ڿ����е�ȼ�� |
C��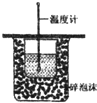 �ⶨ�к��� |
D�� �������������������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com