
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A. 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. SiO2是良好的半导体材料,常用于制造计算机的芯片
C. Fe2O3俗称铁红,常用作红色的油漆和涂料
D. Cl2可用于自来水的杀菌消毒
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】无机盐对于维持生物体的生命活动具有重要作用。下列无机盐中,缺乏后会导致哺乳动物血液运输O2的能力下降的是( )
A. Fe2+ B. Mg2+ C. Ca2+ D. Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

(1)△H____________ (填“>”“<”或“不能确定”)0。
(2)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。

(2)在3 L容积可变的密闭容器中发生反应②,已知
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;每消耗6.4g甲醇转移的电子数为_______________。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为电化学降解NO![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
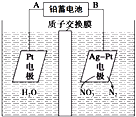
A. 铅蓄电池的A极为阴极
B. 电解的过程中有H+从右池移动到左池
C. 该电解池的阴极反应为:2NO3- + 6H2O + 12e- = N2↑ + 12OH-
D. 若电解过程中转移1moL电子,则交换膜两侧电解液的质量变化差为7.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是 ( )

A. 浓H2SO4B. NaCl溶液C. Ba(OH)2溶液D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
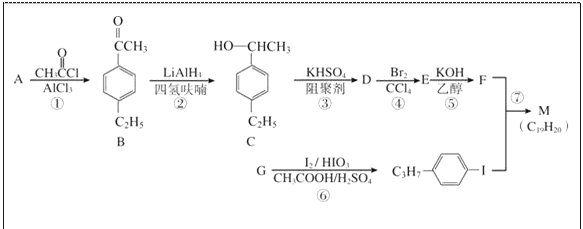
回答下列问题:
(1)A的分子式为____________。
(2)D中含有的官能团是____________,分子中最多有____________个碳原子共平面。
(3)①的反应类型是____________,③的反应类型是____________。
(4)⑤的化学方程式为________________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线: _____________。
的合成路线: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________(填写字母代号)。
A.铝的表面生成致密的薄膜 B.大理石雕像被酸雨腐蚀毁坏
C.食物腐败 D.燃放烟花
(2)过氧化氢水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl==2NaCl+H2O2 B.Ag2O+H2O2==2Ag+O2↑+H2O
C.2H2O2==2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH==2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)________,H2O2既体现氧化性又体现还原性的反应是________。
②H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为________。
(3)氯化铵常用于焊接金属。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②反应中若产生0.2 mol的气体,则有________mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列叙述中正确的是
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失去电子多的还原剂还原性强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com