



 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
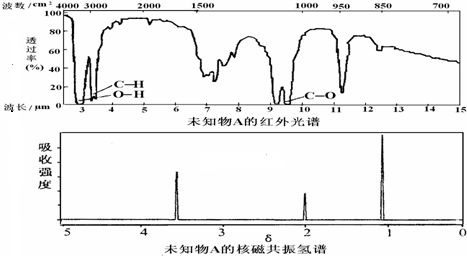
| A、由红光外谱可知,该有机物中至少有三种不同的化学键 |
| B、由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 |
| C、仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
| D、若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由分子间作用力结合而成,熔点低 |
| B、固体或熔融后易导电,熔点在1000℃左右 |
| C、由共价键结合成网状结构,熔点高 |
| D、固体不导电,但溶于水或熔融后能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 江西某铜业公司在火炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )
江西某铜业公司在火炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )| A、自然界化合态硫以FeS2、CuFeS2等形式存在 |
| B、火法炼铜的矿石原料主要含Cu2S |
| C、该公司炼铜产生的SO2可用于生产H2SO4 |
| D、lmol/L H2SO4溶液可储存于铁制或铝制容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,请补充完整以下合成路线(无机试剂任选,需注明反应条件).CH2═CHCH3
,请补充完整以下合成路线(无机试剂任选,需注明反应条件).CH2═CHCH3| Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别露置在空气中,容器内溶质的物质的量浓度都降低 |
| B、都是常用的干燥剂 |
| C、不能用铝制槽罐来运输浓硝酸 |
| D、和铜反应中都表现出强氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com