
【题目】25℃时,向50mL浓度均为l.0mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知:25℃时,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是

A.a点溶液中,c(H+)约为![]()
B.b点溶液中,![]()
C.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大
D.从a到c的过程中,溶液中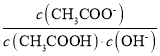 不变
不变
【答案】C
【解析】
根据Ka(CH3COOH)=1.8×10-5可知当溶液呈中性时![]() ,
,![]() ,
,
A. a点溶液中c(CH3COOH)≈c(CH3COO-),氢离子浓度主要来源于醋酸的电离:CH3COOH![]() CH3COO-+H+,
CH3COO-+H+, ![]() ,即c(H+)约为
,即c(H+)约为![]() ,故A正确;
,故A正确;
B. b点溶液中,醋酸未反应完,此时溶质为醋酸与醋酸钠,浓度之比为3:7,溶液呈酸性,醋酸钠完全电离,醋酸部分电离,则![]() ,故B正确;
,故B正确;
C. 当V(NaOH)=50mL时,溶液中溶质为醋酸钠,浓度为1.0mol/L,此时溶液中离子总浓度小于原溶液,故C错误;
D. 从a到c的过程中,温度保持不变,水解平衡常数不变,则溶液中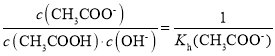 不变,故D正确;
不变,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
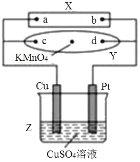
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年我国废旧锂离子电池的产生将达到爆发期,某高校实验室利用废旧钴酸锂正极片进行钴酸锂的再生工艺设计如下,请回答下列问题:
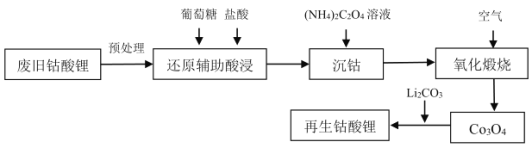
(1)拆解废旧电池前需要进行放电,以避免在拆解过程中因局部短路起火,放电方式为电化学放电,可以将废旧电池浸泡在_____________中进行放电。
A.酒精 B.98%H2SO4C.Na2SO4溶液
(2)预处理时,钴酸锂(Li0.5CoO2)高温下分解得到LiCoO2、Co3O4和一种气体,该反应的化学方程式为_________________。
(3)已知难溶物CoC2O4的Ksp=4.0×10-6,一般认为离子浓度达到10-5mol/L时即完全除尽。沉钴过程中,当Co2+完全沉淀时,溶液中![]() 的浓度至少为_________mol/L。
的浓度至少为_________mol/L。
(4)沉钴过程中,草酸盐体系中钴离子形态分布如图,在不同pH范围钴离子形态不同的原因___________________。

(5)在空气氛围下CoC2O42H2O氧化分解制备Co3O4的失重曲线如图所示,已知![]() 失重率大约为19.7%;
失重率大约为19.7%;![]() 失重率大约为36.3%;
失重率大约为36.3%;![]() 失重率大约为3.0%。请写出
失重率大约为3.0%。请写出![]() 发生的化学反应方程式______________________。
发生的化学反应方程式______________________。
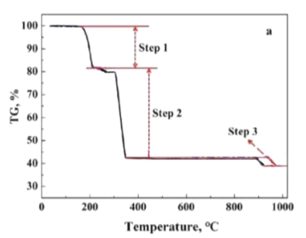
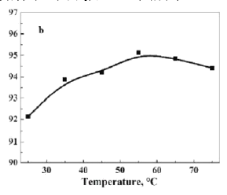
(6)已知生成草酸钴的过程为吸热过程。在![]() ,沉淀时间
,沉淀时间![]() ,考察温度对Co2+沉淀率的影响,结果如图所示,沉淀率呈先增大后减小的趋势的原因可能____________。
,考察温度对Co2+沉淀率的影响,结果如图所示,沉淀率呈先增大后减小的趋势的原因可能____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图:
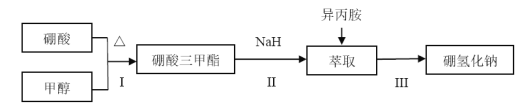
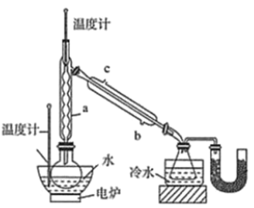
硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。
硼酸三甲酯B(OCH3)3 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)直形冷凝管冷却水应从________(填“b”或“c”)接口进入。
(2)浓硫酸的作用是_______。
(3)本实验采用水浴加热,优点是________;U型管中试剂的作用是__________。
(4)在240℃条件下进行,硼酸三甲酯与氢化钠反应制取NaBH4,同时生成CH3ONa,写出该反应的化学方程式______。
(5)萃取时可采用索氏提取法,其装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。当萃取完全后,硼氢化钠在_______(填“圆底烧瓶”或“索氏提取器”)中。
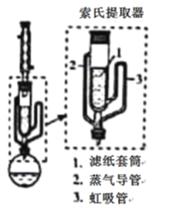
(6)分离NaBH4并回收溶剂,采用的方法是_______。
(7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转,结构简式为下图的烃,下列说法正确的是:
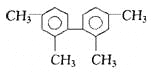
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.该烃的一氯取代物最多有3种
D.该烃是苯的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com