
【题目】2020年我国废旧锂离子电池的产生将达到爆发期,某高校实验室利用废旧钴酸锂正极片进行钴酸锂的再生工艺设计如下,请回答下列问题:
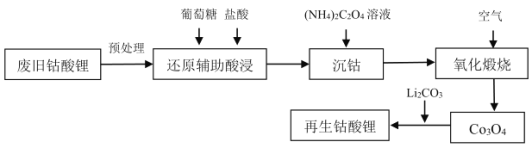
(1)拆解废旧电池前需要进行放电,以避免在拆解过程中因局部短路起火,放电方式为电化学放电,可以将废旧电池浸泡在_____________中进行放电。
A.酒精 B.98%H2SO4C.Na2SO4溶液
(2)预处理时,钴酸锂(Li0.5CoO2)高温下分解得到LiCoO2、Co3O4和一种气体,该反应的化学方程式为_________________。
(3)已知难溶物CoC2O4的Ksp=4.0×10-6,一般认为离子浓度达到10-5mol/L时即完全除尽。沉钴过程中,当Co2+完全沉淀时,溶液中![]() 的浓度至少为_________mol/L。
的浓度至少为_________mol/L。
(4)沉钴过程中,草酸盐体系中钴离子形态分布如图,在不同pH范围钴离子形态不同的原因___________________。

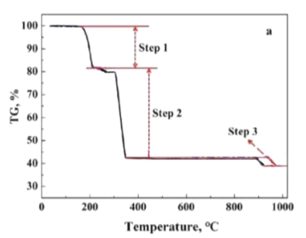
(5)在空气氛围下CoC2O42H2O氧化分解制备Co3O4的失重曲线如图所示,已知![]() 失重率大约为19.7%;
失重率大约为19.7%;![]() 失重率大约为36.3%;
失重率大约为36.3%;![]() 失重率大约为3.0%。请写出
失重率大约为3.0%。请写出![]() 发生的化学反应方程式______________________。
发生的化学反应方程式______________________。
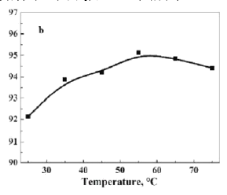
(6)已知生成草酸钴的过程为吸热过程。在![]() ,沉淀时间
,沉淀时间![]() ,考察温度对Co2+沉淀率的影响,结果如图所示,沉淀率呈先增大后减小的趋势的原因可能____________。
,考察温度对Co2+沉淀率的影响,结果如图所示,沉淀率呈先增大后减小的趋势的原因可能____________。
【答案】C 6Li0.5CoO2![]() 3LiCoO2+Co3O4+O2↑ 0.4 低pH范围时,
3LiCoO2+Co3O4+O2↑ 0.4 低pH范围时,![]() 水解为H2C2O4和
水解为H2C2O4和![]() ;随着pH增高,
;随着pH增高,![]() 水解程度降低 3CoC2O4+2O2
水解程度降低 3CoC2O4+2O2![]() Co3O4+6CO2 温度的提高有利于增加Co2+与
Co3O4+6CO2 温度的提高有利于增加Co2+与![]() 的有效碰撞(或沉淀速率),同时由于草酸钴的沉淀反应是吸热反应,温度升高有利于沉淀反应正移;由于草酸钻的溶解度在较高温度下可能会増大,因此过高温度反而在一定程度上降低Co2+的沉淀率
的有效碰撞(或沉淀速率),同时由于草酸钴的沉淀反应是吸热反应,温度升高有利于沉淀反应正移;由于草酸钻的溶解度在较高温度下可能会増大,因此过高温度反而在一定程度上降低Co2+的沉淀率
【解析】
废旧钴酸锂(Li0.5CoO2)电池预处理时,Li0.5CoO2高温分解得到LiCoO2、Co3O4和O2;加入葡萄糖和盐酸进行还原辅助酸浸,钴元素转化为CoCl2;加入(NH4)2C2O4溶液沉钴,Co2+转化为CoC2O4沉淀;在空气中氧化煅烧,CoC2O4转化为Co3O4;再用Li2CO3处理,即转化为Li0.5CoO2。
(1)废旧电池电化学放电,需发生原电池反应,所以可以将废旧电池浸泡在电解质溶液中进行放电,酒精和98%H2SO4都不能导电,只有Na2SO4溶液能导电,故选C。答案为:C;
(2)预处理时,钴酸锂(Li0.5CoO2)高温下分解得到LiCoO2、Co3O4和一种气体,由于Co元素化合价降低,则气体为O2,该反应的化学方程式为6Li0.5CoO2![]() 3LiCoO2+Co3O4+O2↑。答案为:6Li0.5CoO2
3LiCoO2+Co3O4+O2↑。答案为:6Li0.5CoO2![]() 3LiCoO2+Co3O4+O2↑;
3LiCoO2+Co3O4+O2↑;
(3)沉钴过程中,当Co2+完全沉淀时,c(Co2+)≤10-5mol/L,c(![]() )=
)=![]() mol/L≥0.4 mol/L,所以溶液中
mol/L≥0.4 mol/L,所以溶液中![]() 的浓度至少为0.4mol/L。答案为:0.4;
的浓度至少为0.4mol/L。答案为:0.4;
(4)沉钴过程中,草酸盐体系中钴离子形态分布如图,pH较小时,主要生成钴的草酸氢盐,因为酸性较强溶液中,草酸根水解转化为草酸氢根或草酸,所以在不同pH范围钴离子形态不同的原因为:低pH范围时,![]() 水解为H2C2O4和
水解为H2C2O4和![]() ;随着pH增高,
;随着pH增高,![]() 水解程度降低。答案为:低pH范围时,
水解程度降低。答案为:低pH范围时,![]() 水解为H2C2O4和
水解为H2C2O4和![]() ;随着pH增高,
;随着pH增高,![]() 水解程度降低;
水解程度降低;
(5)设加热前,CoC2O42H2O的质量为183g,即CoC2O42H2O为1mol,则![]() 失重率大约为19.7%时,剩余固体质量为183g×(1-19.7%)=147g;
失重率大约为19.7%时,剩余固体质量为183g×(1-19.7%)=147g;![]() 失重率大约为36.3%,剩余固体质量为183g×(1-19.7%-36.3%)=80.5g;
失重率大约为36.3%,剩余固体质量为183g×(1-19.7%-36.3%)=80.5g;![]() 失重率大约为3.0%,剩余固体质量为183g×(1-19.7%-36.3%-3.0%)=75g。则
失重率大约为3.0%,剩余固体质量为183g×(1-19.7%-36.3%-3.0%)=75g。则![]() 时,失重183g-147g=36g,
时,失重183g-147g=36g,![]() =2mol,则此时刚好失去全部结晶水,所得固体为CoC2O4;
=2mol,则此时刚好失去全部结晶水,所得固体为CoC2O4;![]() 时,依据流程图中提供的信息,产物为Co3O4(也可从
时,依据流程图中提供的信息,产物为Co3O4(也可从![]() =241.5g/mol得到证实);
=241.5g/mol得到证实);![]() 时,M(产物)=
时,M(产物)=![]() =75g/mol,则其为CoO。因此
=75g/mol,则其为CoO。因此![]() 时,CoC2O4转化Co3O4,此时应有O2参与反应,且产物中还有碳的氧化物CO2,发生的化学反应方程式3CoC2O4+2O2
时,CoC2O4转化Co3O4,此时应有O2参与反应,且产物中还有碳的氧化物CO2,发生的化学反应方程式3CoC2O4+2O2![]() Co3O4+6CO2。答案为:3CoC2O4+2O2
Co3O4+6CO2。答案为:3CoC2O4+2O2![]() Co3O4+6CO2;
Co3O4+6CO2;
(6)因为生成草酸钴的过程为吸热过程,所以升高温度平衡正向移动,Co2+沉淀率增大,后来沉淀率下降,应由溶解度的增大引起。所以沉淀率呈先增大后减小的趋势的原因可能为:温度的提高有利于增加Co2+与![]() 的有效碰撞(或沉淀速率),同时由于草酸钴的沉淀反应是吸热反应,温度升高有利于沉淀反应正移;由于草酸钻的溶解度在较高温度下可能会増大,因此过高温度反而在一定程度上降低Co2+的沉淀率。答案为:温度的提高有利于增加Co2+与
的有效碰撞(或沉淀速率),同时由于草酸钴的沉淀反应是吸热反应,温度升高有利于沉淀反应正移;由于草酸钻的溶解度在较高温度下可能会増大,因此过高温度反而在一定程度上降低Co2+的沉淀率。答案为:温度的提高有利于增加Co2+与![]() 的有效碰撞(或沉淀速率),同时由于草酸钴的沉淀反应是吸热反应,温度升高有利于沉淀反应正移;由于草酸钻的溶解度在较高温度下可能会増大,因此过高温度反而在一定程度上降低Co2+的沉淀率。
的有效碰撞(或沉淀速率),同时由于草酸钴的沉淀反应是吸热反应,温度升高有利于沉淀反应正移;由于草酸钻的溶解度在较高温度下可能会増大,因此过高温度反而在一定程度上降低Co2+的沉淀率。


科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
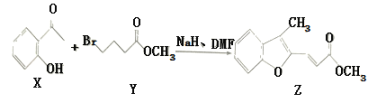
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,Z原子2p轨道上有3个未成对电子,甲、乙、丙、丁、戊是这四种元素的两种或三种形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下己溶液显中性,它们有如下转化关系(反应条件已略去):
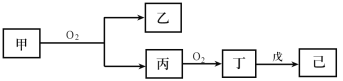
则下列说法中错误的是
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.可以用酸性KMnO4溶液鉴别甲和丙
C.己溶于水后促进了水的电离
D.W的氢化物不一定比Y的稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL浓度均为l.0mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知:25℃时,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是

A.a点溶液中,c(H+)约为![]()
B.b点溶液中,![]()
C.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大
D.从a到c的过程中,溶液中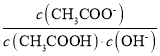 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池,电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1mol CH4,可以向外电路提供约![]()
![]() 的电量;
的电量;
②负极上CH4失去电子,电极反应式为: CH4-8e-+10OH—=CO32-+7H2O
③负极上是O2获得电子,电极反应式为![]() ;
;
④电池放电后,溶液pH不断升高
A.①②B.①③C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
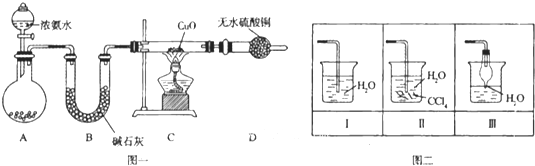
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的2mL气体可能分别是
A.1.2mL,NOB.2.4mL,O2
C.3.5mL,O2D.4mL,NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由原料M合成高分子K的某种合成路线如图:
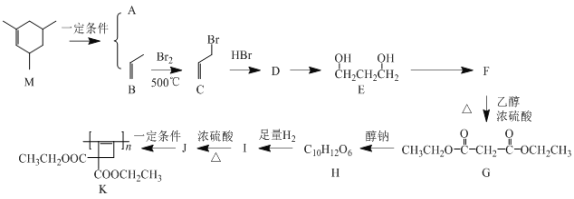
已知:
①![]()
②![]() +HO—R’
+HO—R’
③H2C=C=CH2结构不稳定,将转化为HC![]() C—CH3
C—CH3
(1)A的系统命名为___。
(2)由D生成E过程的化学方程式为___。
(3)由G生成H过程的反应类型为___。
(4)I的结构简式为___。
(5)J中所含官能团名称为___。
(6)X是比M分子量少14的同系物,则具有下列条件的X的结构有___种。
①含有六元环
②能使溴水褪色
(7)利用上述流程的相关信息及所学知识,设计流程,由乙醇合成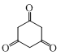 ___。
___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com